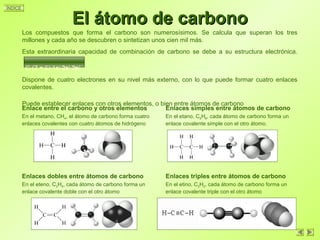
Este documento trata sobre la química del carbono. Explica que el carbono se encuentra de forma combinada en la atmósfera, corteza terrestre y materia viva, y de forma libre como diamante y grafito. Describe el ciclo del carbono y las propiedades del átomo de carbono que le permiten formar múltiples compuestos. Finalmente, clasifica los compuestos de carbono en hidrocarburos, derivados halogenados y compuestos oxigenados y nitrogenados.