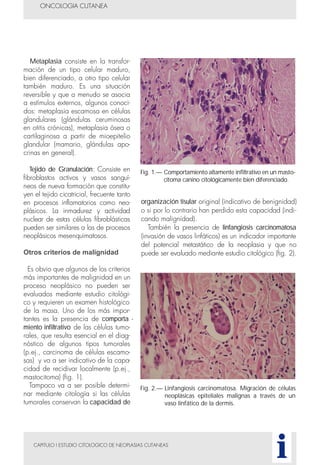
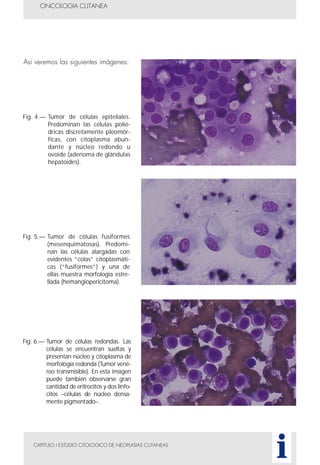
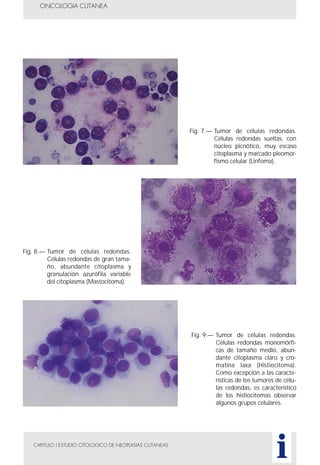
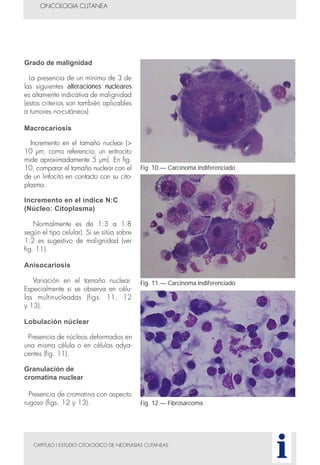
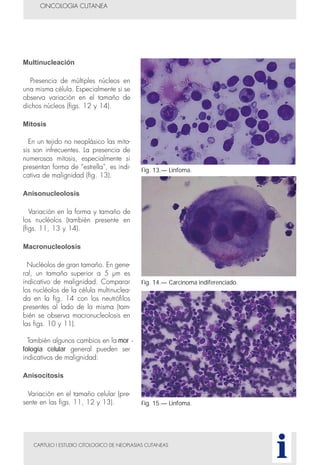
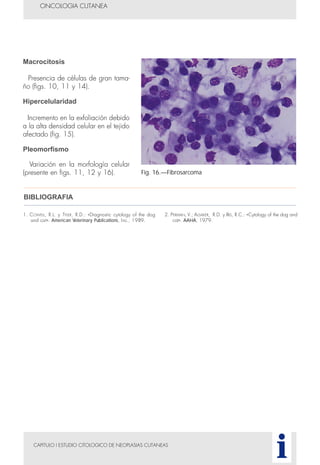
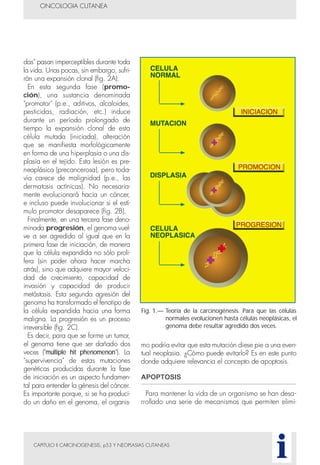
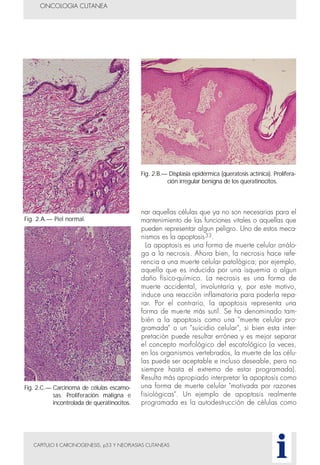
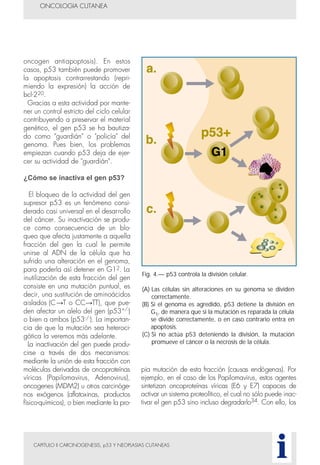
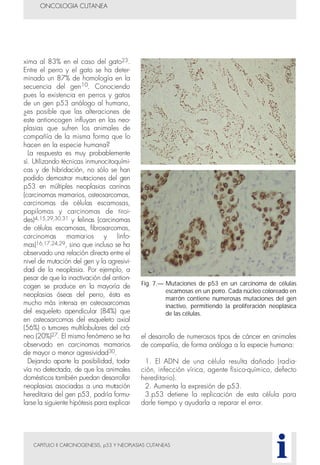
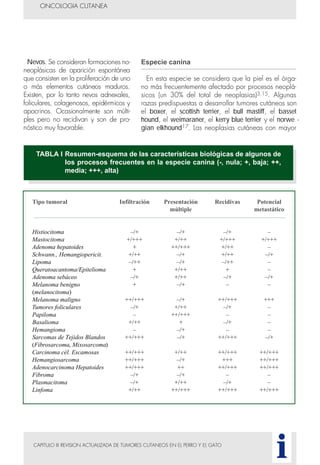
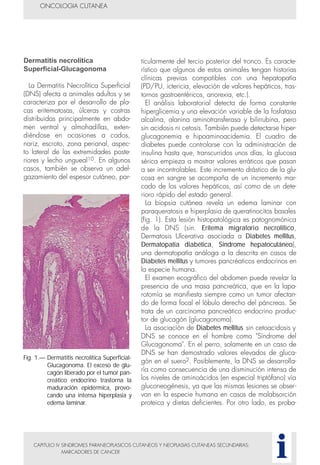
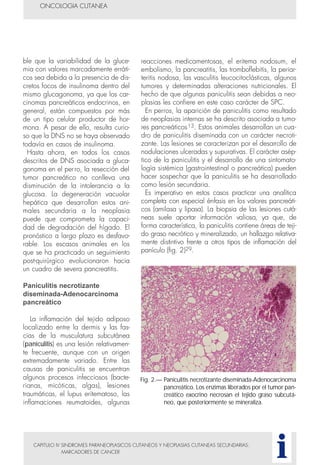
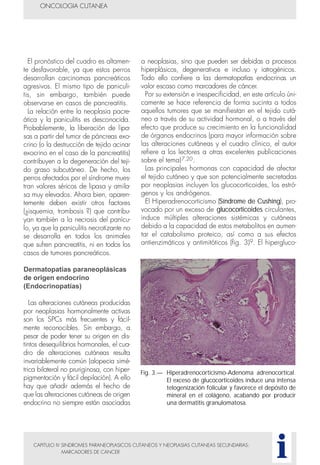
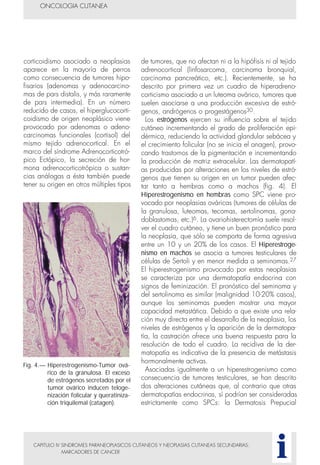
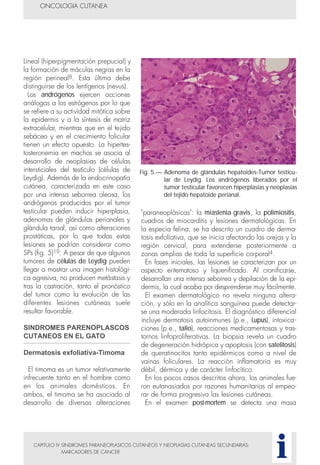
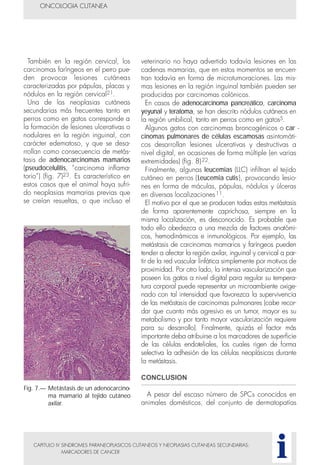
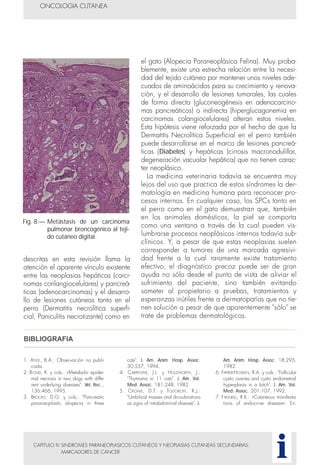
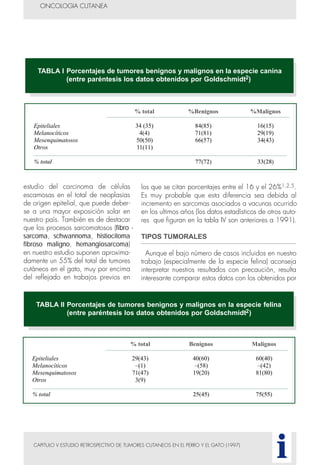
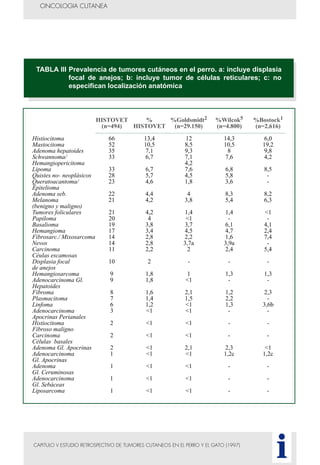
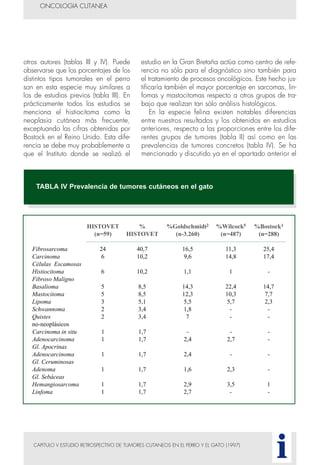
Este documento presenta tres métodos para estudiar citológicamente las neoplasias cutáneas en perros y gatos: (1) aspiración con aguja fina, (2) improntas, y (3) examen microscópico de las muestras. El estudio citológico proporciona información valiosa de forma rápida y económica, pero tiene limitaciones como examinar solo una pequeña área y no poder evaluar todos los criterios de malignidad. Se recomienda interpretar los resultados con cuidado y considerar también los datos cl