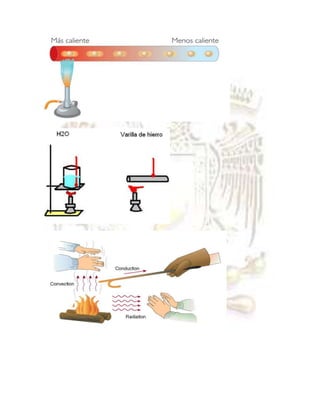
Este documento presenta tres experimentos sobre calor y temperatura realizados por estudiantes. El primero demuestra que al calentar agua su temperatura aumenta. El segundo muestra que un tubo de metal al ser calentado alcanza un equilibrio térmico. El tercero comprueba que la temperatura de dos muestras de agua calentadas por tiempos diferentes depende directamente de la cantidad de calor aplicada.