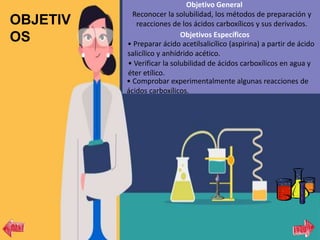
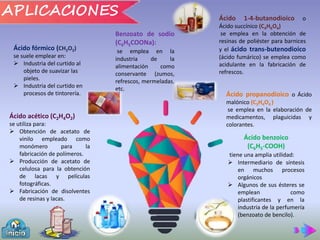
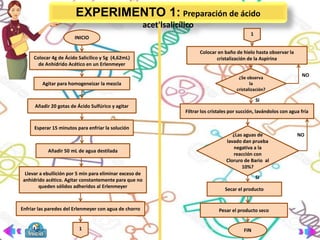
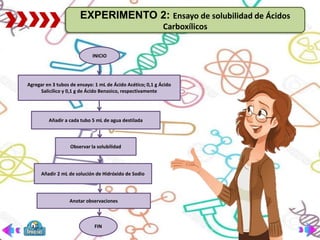
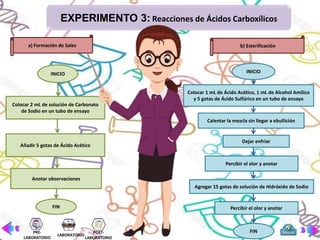
Este documento presenta la práctica de laboratorio sobre la preparación, propiedades y reacciones de los ácidos carboxílicos y sus derivados. El objetivo general es reconocer la solubilidad, métodos de preparación y reacciones de estos compuestos. Se explican brevemente las bases teóricas sobre ácidos carboxílicos y sus aplicaciones. Finalmente, se describen tres experimentos: 1) preparación de aspirina, 2) ensayo de solubilidad, y 3) reacciones como formación de sales y esterificación.