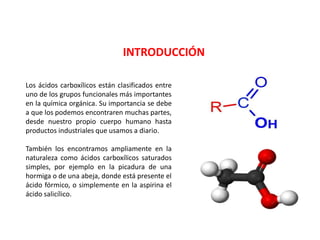
Los ácidos carboxílicos contienen el importante grupo funcional carboxilo. Son compuestos que se encuentran de forma natural en muchos productos como frutas y grasas, y también se utilizan en medicamentos e industria. Algunos derivados como el ácido salicílico y el ácido acetilsalicílico se usan como analgésicos. Los ácidos carboxílicos tienen propiedades físicas y químicas que dependen de su estructura molecular.

















































![Reducción a alcoholes
Para reducir un grupo carboxilato a alcohol se necesitan reductores más enérgicos. Hay que tener precaución
si la molécula posee otros grupos funcionales ya que algunos de ellos pueden reducirse.
Reductor [H] Otros grupos que interfieren
LiALH4 / éter
¡Precaución!. La reacción del LAH con un ácido es fuertemente
exotérmica y puede dar lugar a explosiones o incendios.
BH3 / THF](https://image.slidesharecdn.com/sesion10-acidoscarboxilicos-210811051054/85/Acidos-carboxilicos-51-320.jpg)



























































