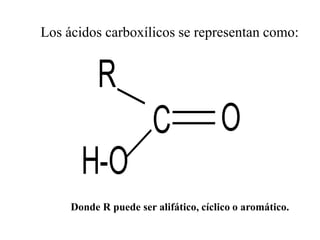
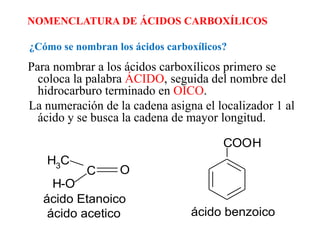
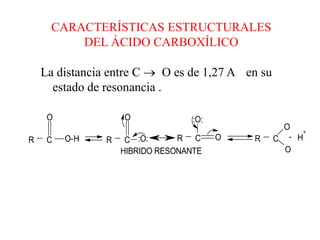
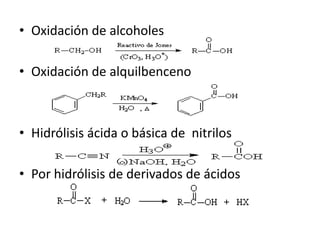
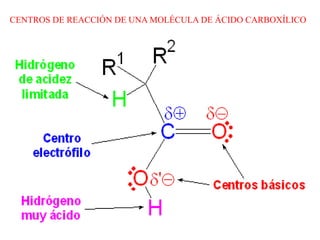
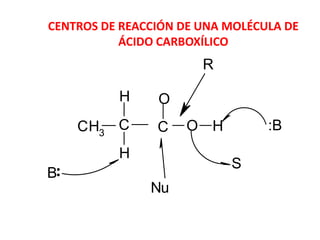
Los ácidos carboxílicos son compuestos orgánicos formados por un grupo carboxilo -COOH unido a una cadena alifática o ciclo. Son ácidos débiles que pueden disociarse en agua para dar un protón e ion carboxilato. Los ácidos carboxílicos tienen numerosas aplicaciones en compuestos naturales como aminoácidos y ácidos grasos. Sus derivados funcionales incluyen haluros de acilo, anhídridos de acilo, ésteres y amidas.