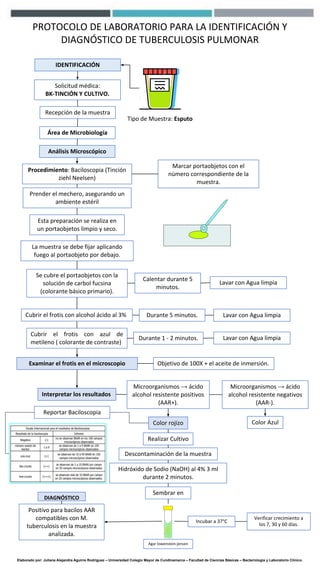
Este protocolo de laboratorio describe los pasos para identificar y diagnosticar la tuberculosis pulmonar a través de una muestra de esputo. Incluye tinción de Ziehl-Neelsen para visualizar bacilos ácido-alcohol resistentes bajo el microscopio, cultivo en medio Lowenstein-Jensen para verificar el crecimiento de Mycobacterium tuberculosis, y reportar los resultados de la baciloscopia para el diagnóstico.