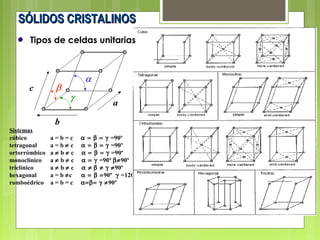
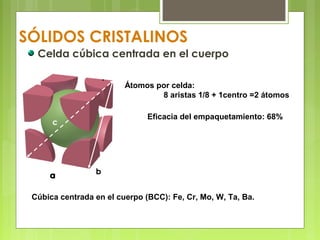
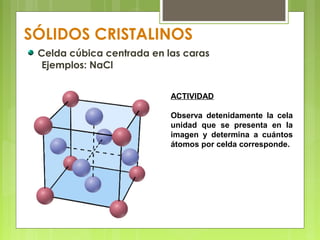
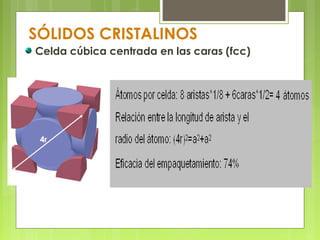
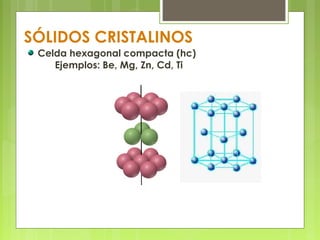
El documento describe las características de los sólidos. Los sólidos tienen forma y volumen determinados, densidades mayores que los líquidos, y las partículas se mueven solo por vibración. Existen sólidos cristalinos ordenados y sólidos amorfos desordenados como el vidrio.