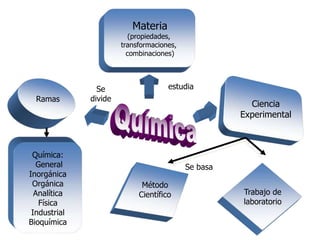
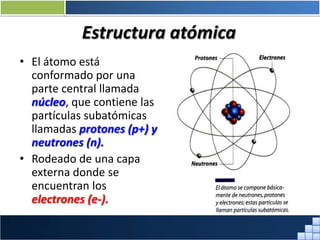
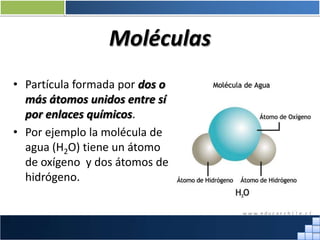
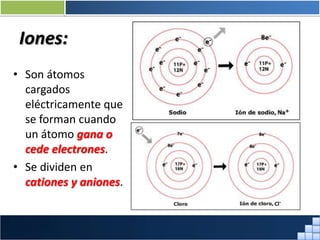
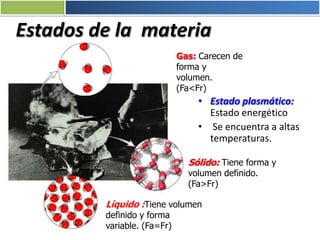
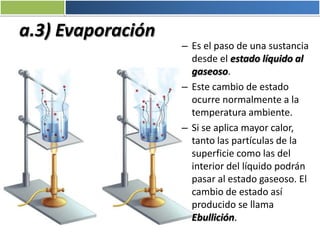
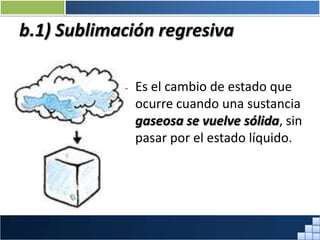
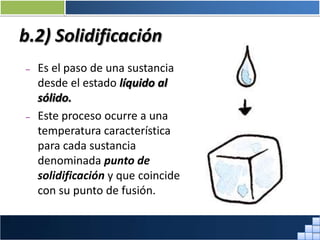
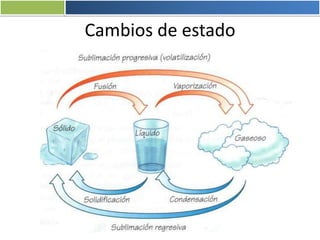
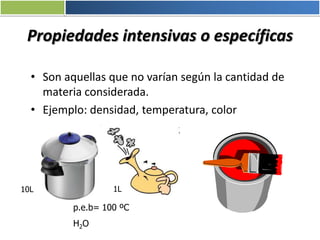
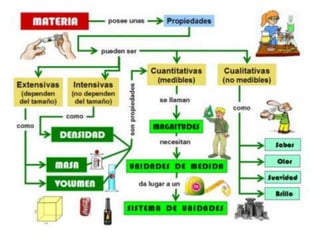
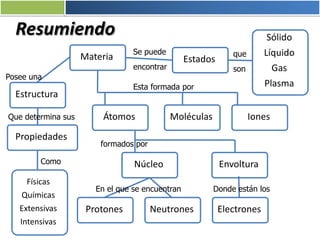
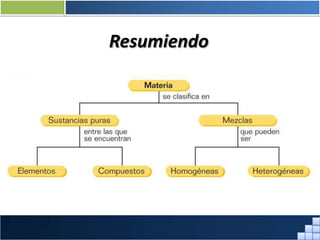
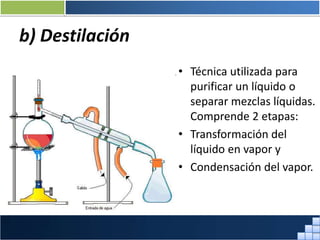
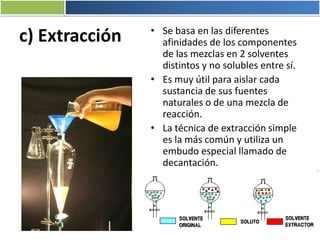
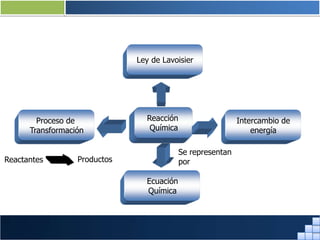
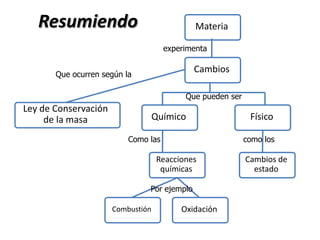
La materia está formada por átomos que se unen para formar moléculas e iones. Puede encontrarse en distintos estados y experimentar cambios de estado. Posee propiedades físicas y químicas que la caracterizan. Se compone de elementos y compuestos químicos puros, así como de mezclas. Experimenta transformaciones a través de cambios físicos, químicos y fenómenos alotrópicos, representados por reacciones químicas.