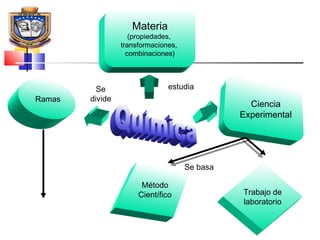
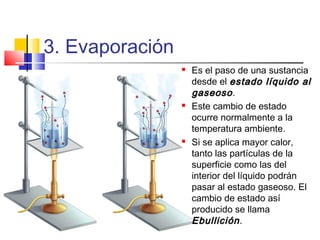
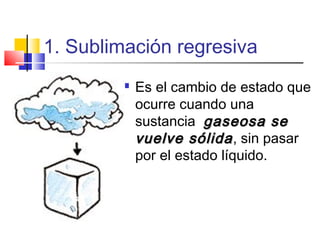
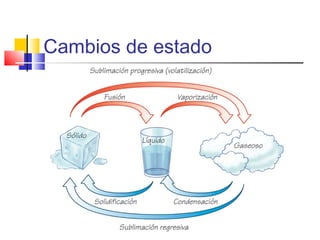
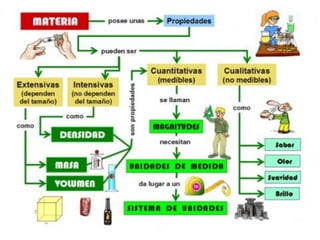
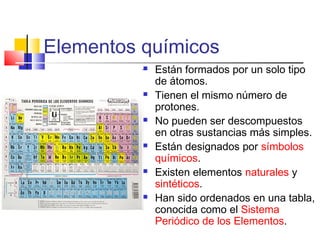
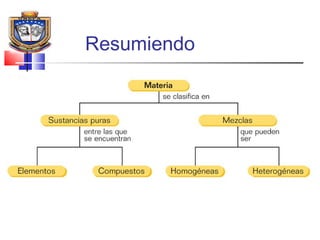
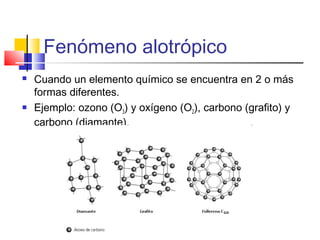
Este documento presenta los conceptos básicos de química. Explica que la materia está compuesta de átomos y moléculas, y puede encontrarse en diferentes estados como sólido, líquido y gas. Describe las propiedades físicas y químicas de la materia, así como los cambios de estado y las transformaciones que puede experimentar, incluyendo los cambios físicos y químicos. También define conceptos como elementos, compuestos, mezclas y reacciones químicas.