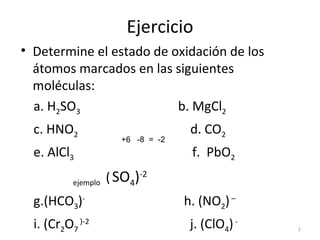
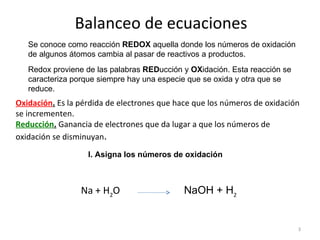
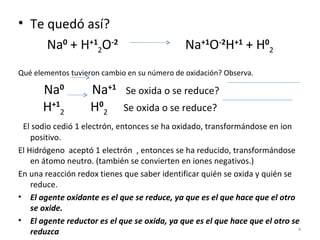
Este documento presenta instrucciones para determinar números de oxidación en moléculas y átomos, y para balancear ecuaciones redox. Explica que una reacción redox es aquella donde los números de oxidación de algunos átomos cambian al pasar de reactivos a productos, con una especie que se oxida y otra que se reduce. Proporciona ejemplos de cómo identificar los elementos que se oxidan o reducen, y los pasos para balancear una ecuación redox como determinar números de oxidación y analizar cambios elementales.