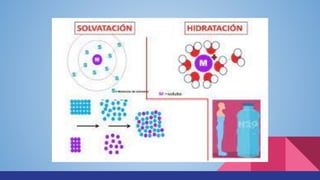
Este documento describe los conceptos básicos de sistemas materiales, sustancias puras, mezclas, soluciones y concentración de soluciones. Explica que un sistema material puede ser homogéneo, heterogéneo o inhomogéneo, y que una mezcla puede ser homogénea o heterogénea. También define sustancias puras, soluciones y las diferentes unidades para expresar la concentración de una solución.