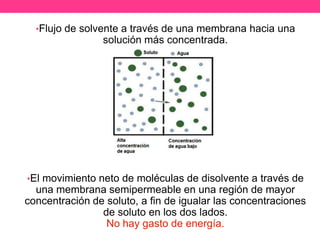
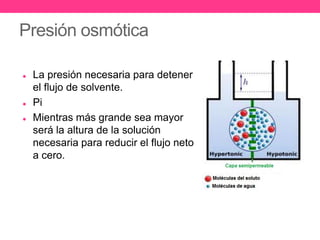
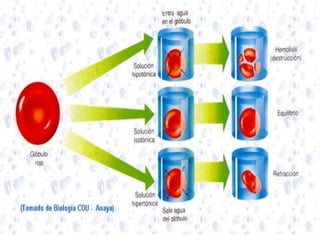
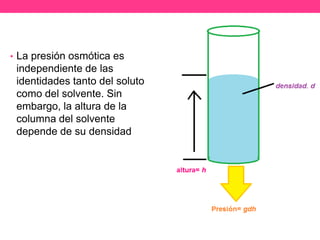
La osmosis es el flujo de solvente a través de una membrana semipermeable hacia una solución de mayor concentración de soluto. La presión osmótica es la presión necesaria para detener este flujo y está directamente relacionada con la concentración molar del soluto según la ecuación de Van't Hoff. La osmosis juega un papel importante en procesos biológicos como el transporte de nutrientes en las células.