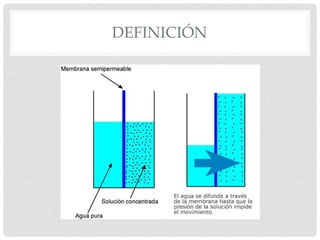
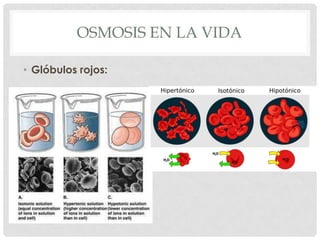
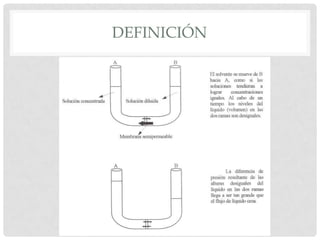
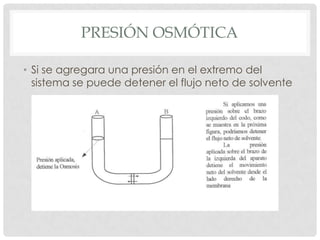
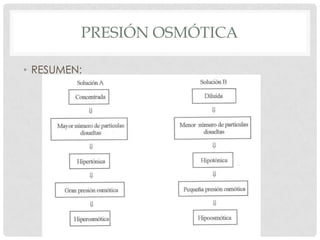
El documento define la presión osmótica como la presión que debe aplicarse a una solución para detener el flujo neto de disolvente a través de una membrana semipermeable. Las membranas semipermeables permiten el paso de pequeñas moléculas como el agua pero detienen moléculas grandes como iones. La presión osmótica depende de la concentración de partículas en la solución y se calcula usando la ecuación de Van't Hoff. Las soluciones pueden ser isotónicas, hipertónic