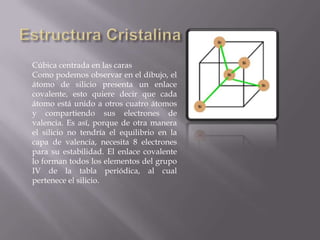
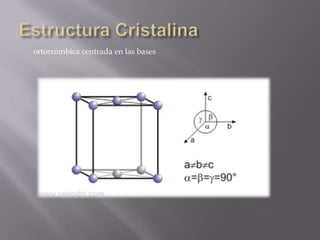
El silicio es el segundo elemento más abundante en la corteza terrestre después del oxígeno. Se presenta en forma amorfa o cristalizada, y es un semiconductor muy importante utilizado en la industria electrónica y fotovoltaica debido a su abundancia.