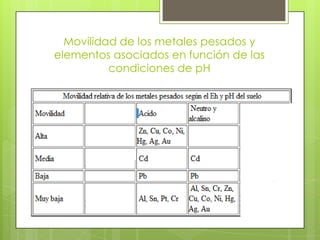
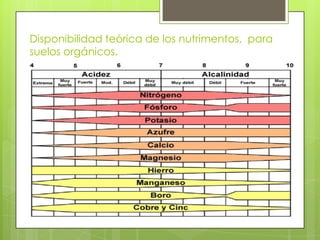
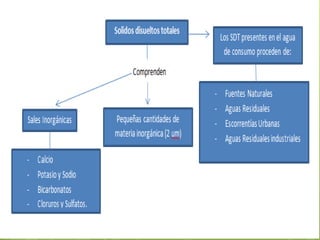
Este documento trata sobre los metales de transición, su importancia ambiental y propiedades como el estado de oxidación, magnetismo y formación de iones complejos. Los metales de transición son tóxicos y tienen un impacto ambiental significativo. Su disponibilidad depende del pH y la alcalinidad del medio. Algunos ejemplos de metales tóxicos son el mercurio, cadmio, plomo y cromo.



![Algunas propiedades
Estados de oxidación
Los metales de transición adquieren diversos estados de oxidación en sus
compuestos mediante la pérdida de uno o más electrones.
Magnetismo
La mayoría de los compuestos de los metales de transición son
paramagnéticos. El paramagnetismo de los compuestos de los metales de
transición se debe a las subcapas d incompletas en los metales.
Formación de iones complejos
Los iones de los metales de transición son ácidos de Lewis (pueden aceptar
pares de electrones) y forman complejos como [(Cu(NH3)5]2+, [Co(NH3)6]3+,
[Ni(CN)4]2- y [Fe(CN)6]3-](https://image.slidesharecdn.com/metalesdetransicin-121123125455-phpapp02/85/Metales-de-transicion-4-320.jpg)