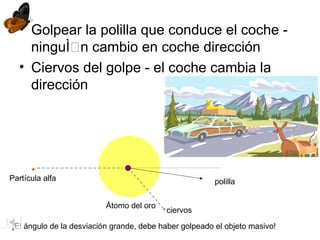
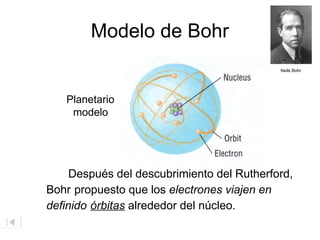
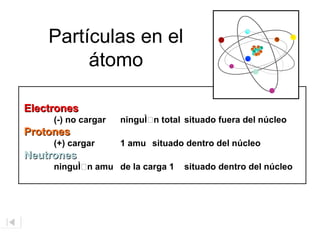
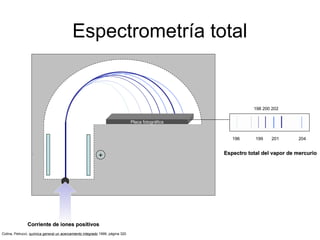
El documento aborda la estructura atómica y la evolución histórica de la teoría atómica desde los griegos hasta los descubrimientos científicos en el siglo XX. Se discuten conceptos fundamentales como la existencia de átomos, partículas subatómicas, ley de conservación de la masa, y la naturaleza de la radiación. También se presentan modelos atómicos de Dalton, Thomson, Rutherford y otros científicos clave que contribuyeron a nuestra comprensión actual de la materia.