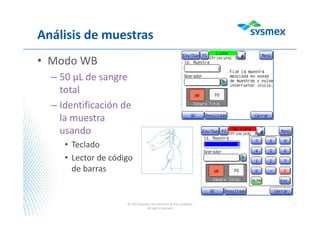
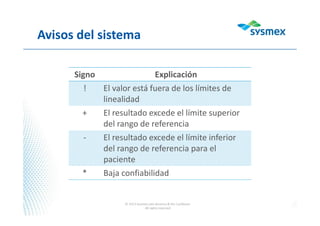
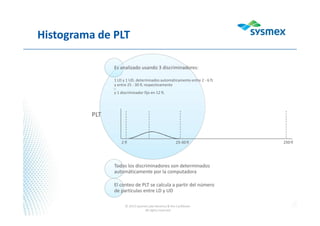
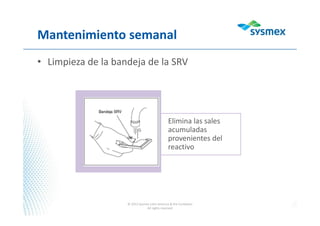
El documento proporciona instrucciones para usar WebEx y participar en una presentación de forma remota. Se recomienda activar el audio y sistema de voz en WebEx, mantener el micrófono en modo "mute" durante la presentación para escuchar mejor y evitar interferencia, y usar la ventana de chat para tomar notas y hacer preguntas al final.