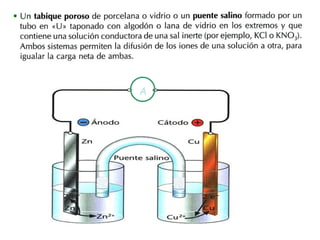
Este documento trata sobre las reacciones redox. Explica que son procesos de oxidación-reducción importantes económicamente y presentes en procesos cotidianos. Define la oxidación como la pérdida de electrones y la reducción como la ganancia de electrones. También describe las pilas voltaicas y cómo generan corriente eléctrica a través del movimiento de electrones entre los electrodos durante las reacciones redox.