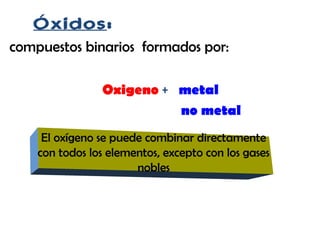
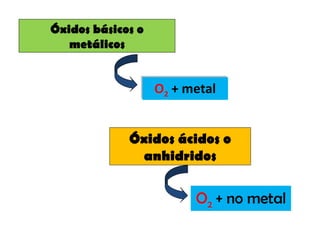
Los óxidos son compuestos binarios formados por la combinación de oxígeno con un metal o no metal. Existen dos tipos de óxidos: óxidos básicos, que se forman cuando el oxígeno se combina con un metal, y óxidos ácidos, que se forman cuando el oxígeno se combina con un no metal. Los óxidos básicos son iónicos y tienen estructuras cristalinas con altos puntos de fusión y ebullición, mientras que los óxidos ácidos son covalentes y tienen puntos de fusión y e