Este documento trata sobre la termodinámica y los principios de la espontaneidad de los procesos. Explica que la entropía y la energía libre son factores que influyen en si un proceso es espontáneo, además de la entalpía. Define estas magnitudes termodinámicas y cómo se pueden usar para predecir si un proceso ocurrirá espontáneamente.









![ENERGÍA LIBRE
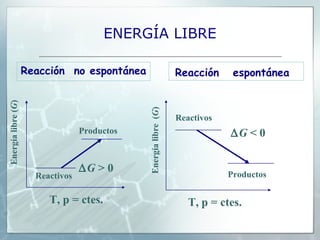
Con la expresión ΔG = ΔH –TΔS se puede evaluar la
tendencia de un sistema a evolucionar de forma
espontánea.
ΔH ΔS ΔG Observaciones
< 0 >0 <0 Espontáneo siempre
exotérmica Aumenta desorden
<0 < 0 Tbaja → < 0 Espontáneo si [ΔH] > TΔS
exotérmica Disminuye Talta → > 0 No espontáneo si [ΔH] < TΔS
desorden
>0 <0 >0 No espontáneo
endotérmica Disminuye
desorden
>0 >0 Tbaja → > 0 No espontáneo si [ΔH] > TΔS
endotérmica Aumenta desorden Talta → < 0 Espontaneo si [ΔH] < TΔS](https://image.slidesharecdn.com/termoquimica2-130127071733-phpapp02/85/Termoquimica-2-11-320.jpg)

![Tercer principio de la termodinámica
Este principio estable que la entropía de una sustancia (elemento o
compuesto (elemento o compuesto) que se encuentra como cristal
perfecto (perfectamente ordenado), 0 K, es cero
La entropía, por tanto, nunca es negativa ya que a cualquier otra
temperatura la entropía será mayor que cero.
En igualdad de condiciones P,T, las S de los gases son mayores que las
de los líquidos y estas a su vez mayores que las de los sólidos.
La entropía también depende del nº de enlaces de las moléculas .
S(CO) < S(CO2) y S(C6H6) < S(C6H12 )
Como la entropía es una función de estado ΔSº se calcula a partir de las
Sºmolares.
ΔSºr = ∑nPSº[P] - ∑nRSº[R]](https://image.slidesharecdn.com/termoquimica2-130127071733-phpapp02/85/Termoquimica-2-13-320.jpg)
