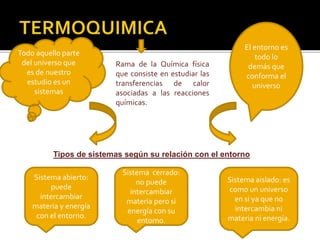
La termoquímica estudia las transferencias de calor asociadas a las reacciones químicas. Los sistemas se clasifican en cerrados, abiertos o aislados según su capacidad de intercambiar materia y energía con el entorno. La energía, trabajo, calor, entropía y entalpía son conceptos fundamentales de la termoquímica, y las leyes de conservación de la energía, el segundo principio de la termodinámica y la ley de Hess son principios básicos.