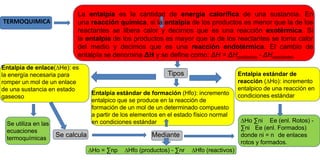
El documento resume conceptos clave de termoquímica como entropía, energía libre de Gibbs, los tres principios de la termodinámica, y la ley de Hess. Explica que la entalpía mide la energía calorífica de una sustancia y que si la entalpía de los productos es menor que la de los reactantes, la reacción libera calor y es exotérmica, mientras que si es mayor, toma calor del medio y es endotérmica. También define la entalpía estándar de reacción y de