El documento trata sobre la reducción de boro en aguas procedentes de la desalación. Presenta una introducción sobre la química del boro y su toxicidad, así como sobre las principales técnicas de desalación como la ósmosis inversa y el intercambio iónico. Detalla los objetivos y alcance de la investigación realizada, que consistió en estudiar la eliminación de boro mediante una segunda etapa de ósmosis inversa y resinas de intercambio iónico en plantas piloto. Finalmente, presenta los resultados obtenidos y un

















![5.47. Concentración de boro del permeado en función
del pH del agua de alimento. Toray TM 710 192
5.48. Concentración de boro del permeado en función del
pH del agua de alimento. Hydranautics ESPA2-4040 193
5.49. Concentración de boro del permeado en función del pH
del agua de alimento. Filmtec BW30-4040 193
5.50. Porcentaje de rechazo de boro frente a pH 194
5.51. Porcentaje de rechazo de boro frente a conversión
a pH 9,8 y pH 11. Toray TM710 196
5.52. Porcentaje de rechazo de boro frente a conversión
a pH 9,8 y pH 11. ESPA2-4040 197
5.53. Porcentaje de rechazo de boro frente a conversión
a pH 8,5 y 10,2. Filmtec BW30 199
5.54. Concentración de boro del alimento y permeado
y temperatura. Filmtec BW30. 201
5.55. Porcentaje de rechazo de boro. Filmtec BW30 201
5.56. Concentración de sodio del alimento y permeado. Filmtec BW30 202
5.57. Porcentaje de rechazo de sodio. Filmtec BW30 203
5.58. Concentración de boro del agua de alimento
y agua tratada. Amberlite IRA 743. 206
5.59. Boro acumulado por la resina. Amberlite IRA 743 207
5.60. Curva de rotura. Amberlite IRA 743 207
5.61. Concentración de boro del agua de alimento
y agua tratada. Purolite S 108 209
5.62. Boro acumulado por la resina. Purolite S 108 210
5.63. Curva de rotura y temperatura. Purolite S 108 210
5.64. Concentración de boro del agua de alimento
y agua tratada. Dow XU-43594.00 212
5.65. Boro acumulado por la resina. Dow XU-43594.00 212
5.66. Curva de rotura. Dow XU-43594.00 213
5.67. Curva de rotura para las tres resinas 215
Ln[C /(C0 − C )] para las tres resinas
5.68. t frente a 216
5.69. Capacidad de saturación de la resina en función de las condiciones
XVII](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-18-320.jpg)





![1. Resumen
En el año 2003 entró en vigor el Real Decreto 140/2003, de 7 de febrero, en el
que se establecen los criterios sanitarios de la calidad del agua de consumo humano,
incorporándose, al ordenamiento jurídico español, los requisitos establecidos en la
Directiva 98/83/CE. En esta normativa se incluye como parámetro de control la
concentración de boro, fijándose como límite máximo 1 mg/L. Las recomendaciones de
la OMS establecen actualmente como límite aconsejable 0,5 mg/L. Por otra parte, la
presencia de concentraciones de boro superiores a 1 mg/L en aguas de regadío puede
perjudicar a un amplio grupo de cultivos sensibles a este elemento.
El boro se encuentra presente en la naturaleza, principalmente en forma de
boratos. Está ampliamente distribuido, tanto en el medio acuático como en el medio
terrestre. La concentración en la que se puede encontrar es muy variada, oscilando
desde los 10 mg/kg en la corteza terrestre hasta los 4,5 mg/kg en los océanos, no
superando, normalmente, los 7 mg/L en las aguas continentales.
El boro presente en el agua se encuentra, de forma natural, como ácido bórico
[B(OH)3] e ión borato[B(OH)4-], formando un equilibrio, en el que la especie
predominante es el ácido bórico, con independencia de que la fuente de boro sea el
ácido bórico o uno de los boratos. Esto es debido a que el ácido bórico es un ácido muy
débil, con una constante de disociación, pKa, de 9,15. A pH superiores a 10, el anión
metaborato [B(OH)4-] comienza a ser la especie dominante.
El agua de mar presenta una concentración de boro con un valor aproximado de
4 mg/L. Una vez llevada a cabo la desalación mediante ósmosis inversa este valor se
reduce hasta 0,8 mg/L–1,5 mg/L, dependiendo de las condiciones de trabajo y de las
membranas empleadas en la desalación. El motivo por el que el boro es rechazado en
tan baja proporción, por las membranas, es que en las aguas naturales se encuentra en
3](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-24-320.jpg)








![2. Introducción
Tabla 2.1. Productos de boro de mayor a menor uso (WHO, 2004).
Substancia Formula Nº CAS
Bórax pentahidratado Na2[B4O5(OH)4]·3H2O
12179-04-3
(tetraborato pentahidratado disódico) (Na2B4O7·5H2O)
Bórax Na2[B4O5(OH)4]·8H2O
1303-96-4
(tetraborato decahidratado disódico) (Na2B4O7·10H2O)
NaCa[B5O6(OH)6]·5H2O
Ulexita 1319-33-1
(Na2O·2CaO·5B2O3·16H2O)
Ca[B3O4(OH)3]·H2O
Colemanita 1318-33-8
(2CaO·5B2O3·5H2O)
Na2[B2O4(OH)4]·6H2O
Perborato sódico tetrahidratado 10486-00-7
(NaBO3 ·4H2O)
Na2[B2O4(OH)4]
Perborato sódico monohidratado 10332-33-9
(NaBO3 ·H2O)
B(OH)3
Ácido bórico 10043-35-3
(H3BO3)
Bórax anhídrido
Na2B4O7 (amorfo) 1330-43-4
(tetraborato de disodio)
Óxido bórico B2O3 (amorfo) 1303-86-2
Boro B 7440-42-8
Las principales aplicaciones del borato son la elaboración y preparación de: fibra
de vidrio de calidad de aislamiento y textil, productos para lavado (perborato sódico),
vidrio de borosilicato, pirorretardantes, fertilizantes y herbicidas agrícolas.
El boro entra en contacto con el medio ambiente a través de dos vías:
• Natural
a. Atmósfera. El boro puede entrar en contacto con el
medioambiente en forma de partículas, a través de la
12](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-33-320.jpg)

![2. Introducción
El boro presente en el agua se encuentra, de forma natural, como ácido bórico
[B(OH)3] e ión borato[B(OH)4-], formando un equilibrio, en el que la especie
predominante es el ácido bórico, con independencia de que la fuente de boro sea el
ácido bórico o uno de los boratos. Esto es debido a que el ácido bórico es un ácido muy
débil con una constante de disociación, pKa, de 9,15. A pH superiores a 10, el anión
metaborato [B(OH)4-] comienza a ser la especie dominante.
Los iones boratos presentes en el agua están básicamente en un estado
totalmente oxidado, no siendo probable que se produzcan procesos de
biotransformación.
Las concentraciones de boro en el aire oscilan entre <0,5 ng/m3 y 80 ng/m3, con
un promedio, en todos los continentes, de 20 ng/m3.
2.1.1. Boro presente en el agua
Como ya se ha comentado, el boro en un medio natural acuoso se encuentra
predominantemente en forma de ácido bórico [B(OH)3]. Éste se comporta como un
ácido de Lewis. El ión hidróxido reacciona con el ión hidrógeno con una constante de
disociación, pKa, de 9,15. El ácido bórico actúa como tal mediante la aceptación de un
par de electrones de un ión OH- entrante más que por transferencia de un protón al
hidróxido (figura 2. 1). En esta reacción el boro pasa de hibridación sp2 a sp3 en el
producto final.
14](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-35-320.jpg)

![2. Introducción
pH
10,00
11,00
12,00
13,00
14,00
1,00
2,00
3,00
4,00
5,00
6,00
7,00
8,00
9,00
0,00
-1,00
-2,00
-3,00 log[HHHAc] ]
log [H3BO3
log[HHAc] 3-]
log [H2BO
-4,00 log[HAc] 2-]
log [HBO 3
log C
log[Ac] 33-]
log [BO
-5,00
-6,00
-7,00
-8,00
-9,00
-10,00
Figura 2.2. Distribución de los diferentes compuestos de boro (Rodríguez y col., 2001).
Al pH en el que se suelen encontrar, tanto el agua de mar como las aguas
naturales, la concentración de HBO32- y de BO33- es despreciable.
Si la concentración de boro en agua es elevada (superior a 0,025 mol/L), dentro
del rango de pH de 6 a 11 se encontrarán formas más complejas poliméricas
[B3O3(OH)4-, B4O5(OH)42-, B5O6(OH)4-, B3O3(OH)4-]. No obstante, la concentración de
estas especies será lo suficientemente baja (en torno a 0,00042 mol/L) como para poder
ser despreciadas (Su y col., 1995).
Como ya se ha comentado, en medio acuoso, la disociación del ácido bórico se
lleva a cabo, realmente, formándose el ión borato en su forma tetraédrica. La presencia
de grupos hidroxilo (OH-) favorece la formación del mismo. La reacción (2.1) se
reescribiría como se muestra a continuación, produciéndose al mismo tiempo la
reacción (2.4).
16](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-37-320.jpg)
![2. Introducción
B (OH ) 3 + H 2 O ↔ B(OH ) 4 + H +
−
con pKa ~ 9,15 (2.1)
B (OH ) 3 + OH − ↔ B(OH ) −
4 con pKb ~ 4,8 (2.4)
Tanto pKa como pKb no son constantes (Hyung y col., 2006), varían en función
de la temperatura y de la fuerza iónica de la disolución (Bartels y col., 2005). pKa
presenta valores entre 8,7 – 9,7 dentro de un intervalo de temperaturas entre 10 y 45ºC.
Por su parte pKb oscila entre 5,2 y 4,4 dentro del mismo rango de temperaturas (Busch y
col., 2003).
La concentración total de boro se puede resumir, de forma simple, como la suma
de las dos especies.
[B]t = [B]B (OH ) + [B]B (OH )
3
−
4
(2.5)
El resto de las posibles especies se presentarían en concentraciones lo
suficientemente bajas como para ser despreciadas.
La figura 2.3. muestra el porcentaje de boro en forma de ácido bórico en función
del pH.
100,0
90,0
80,0
70,0
60,0
50,0
%
40,0
30,0
20,0
10,0
0,0
0,00
1,00
2,00
3,00
4,00
5,00
6,00
7,00
8,00
9,00
10,00
11,00
12,00
13,00
14,00
pH
Figura 2.3. Porcentaje de ácido bórico en función del pH (Rodríguez y col., 2001).
17](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-38-320.jpg)



































![2. Introducción
dπ ⎤
⎡ dP
J V ≈ J W = LP ⎢ −σ
dx ⎥
[LT ]
−1
(2.12)
⎣ dx ⎦
J S = J V C P = PS
dC
dx
+ (1 − σ )J V C [ML−2
T −1 ] (2.13)
donde Jv es el flujo de la solución (m/s) y aproximadamente es igual al flujo de
agua a través de la membrana Jw (m/s), Js es el volumen molar de soluto (mol/(m2s)).
LP= Kw Dwm V /(RT) (m/(Pa s)) es la permeabilidad de agua, Ps=KsDsm (m/s) es el
coeficiente de permeado de soluto; σ es el coeficiente de reflexión de Staverman (indica
el grado de penetración del soluto a través de la membrana, varia entre 0 y 1);
C = K s C m (mol/m3) es una relación entre la concentración de soluto en la disolución
acuosa ideal en equilibrio y la concentración real de soluto Cm en la superficie de la
membrana; Cp (mol/m3) es la concentración de soluto en el agua producto; P (Pa) es la
presión hidráulica; π (Pa) es la presión osmótica correspondiente a un soluto de
concentración C ; Kw y Ks son adimensionales y representan los coeficientes de reparto
del agua y el soluto entre la solución acuosa y la fase de la membrana; Dwm (m2/s) y Dsm
(m2/s) son la difusividad molecular del agua y del soluto en la fase de la membrana.
R=8,312 (Pa m3 /(mol K)) es la constante de los gases ideales; T(K) es la temperatura
absoluta y Vw (m3/mol) es el volumen molar parcial de agua. El subíndice m se refiere a
la fase de la membrana.
Para la ecuación del flujo de soluto a través de la membrana, se considera que el
primer término de la ecuación corresponde al flujo debido a la difusión, mientras que el
segundo corresponde al transporte de soluto debido a la convección (Ballet y col.,
2004). El transporte de soluto por difusión es debido al gradiente de concentraciones a
un lado y otro de la membrana. El transporte por convección tiene lugar debido al
gradiente de presión, asociándose por tanto al flujo de permeado a través de la
membrana (del Castillo, 1997).
Las ecuaciones anteriores, se basan el la suposición de que Kw, Ks, Dwm, Dsm son
constantes respecto a la concentración del soluto.
53](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-74-320.jpg)

![2. Introducción
Las ecuaciones que se aplica según esta teoría se pueden obtener como
simplificación de la teoría de termodinámica irreversible considerando σ =1 (indicador
de la relación de soluto y disolvente en el agua tratada).
Las primeras ecuaciones desarrolladas corresponden a una membrana ideal con
capa homogénea del polímero, en la que la transferencia de masa se efectúa por difusión
molecular, transcurriendo independientemente el transporte del soluto y del disolvente
(Paul y col., 2004). La selectividad de la membrana hacia cada compuesto responde a
los distintos coeficientes de difusión, al tamaño y a la distribución de las redes
moleculares y poros.
Según el modelo de solución-difusión, el transporte de disolvente y del soluto se
produce de forma independiente, siendo el flujo molar de cada uno proporcional al
gradiente químico. Las ecuaciones de flujo de disolvente y de soluto de Lonsdale son
respectivamente:
Para el transporte del disolvente:
J v = A(ΔP - Δπ ) [LT ] −1
(2.18)
donde Jv es el flujo de la solución (m/s), A= Pw/Δx (m/(sPa)). Δx es el espesor de
la capa activa de la membrana. ΔP = (Pf-Pp) representa la diferencia de presión entre el
agua de alimento y el agua de permeado. Δπ es el gradiente presión osmótica a un lado
y otro de la membrana (agua de alimento y agua permeada).
Para el transporte del soluto tenemos:
J S = J V C P = BΔC [ML −2
T −1 ] (2.19)
donde Js es el volumen molar de soluto (mol/(m2s)), B=Ps/Δx (m/s) es el
parámetro de transporte de soluto, Δx (m) es el espesor de la capa activa de la
55](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-76-320.jpg)



![2. Introducción
Siendo k el coeficiente de transferencia de materia, que establece la relación
entre el coeficiente de difusión y el espesor de la capa límite.
k = D/δ (2.26)
Si introducimos el parámetro de retención intrínseca de la membrana:
Rint = 1 - Cp/Cm (2.27)
se puede expresar el “módulo de concentración de polarización”, Cm/Cb, como
Cm/Cb = exp(J/k)/[Rint + (1 - Rint)exp(J/k)] (2.28)
Cuando el soluto es completamente retenido en la membrana Rint = 1 y Cp = 0,
con lo que
Cm/Cb = exp(J/k) (2.29)
Esta es, por tanto, la ecuación básica de la concentración de polarización en
función de los dos factores que la originan relativos a la membrana, J y la
hidrodinámica del sistema, k.
De esta forma el transporte real de soluto a través de la membrana sería:
J S = B(C m − C p ) [ML
−2
T −1 ] (2.30)
El valor de la concentración de sales del agua permeada viene definido como:
CP = ρ
JS
J S + JW
J
≈ ρW S
JW
[ML ]
−3
(2.31)
59](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-80-320.jpg)


















![2. Introducción
siendo: Qt Valor del transporte a la temperatura t.
Q25 Valor del transporte a 25º C.
Kt Constante.
Este factor es fundamental a la hora de establecer el diseño del proceso y las
condiciones de operación del mismo, pero no es relevante a la hora de establecer las
condiciones de funcionamiento con el fin de minimizar la concentración de boro en el
agua tratada.
b. pH
El factor más destacable y sobre el que se debe operar para obtener un mayor
rendimiento del proceso, en cuanto al rechazo de boro, es el pH.
El rechazo del boro por parte de las membranas de ósmosis inversa se ve
notablemente influenciado por el pH del agua. Como se ha señalado en el apartado
2.1.1, el boro en medio natural acuoso se encuentra en forma de ácido bórico [B(OH)3]
principalmente. El ácido bórico se comporta como un ácido de Lewis y al aumentar el
pH se disocia formando el ión borato. Mediante la adición de una base al agua a tratar,
se aumenta el pH de la misma favoreciendo que el equilibrio entre el ácido bórico y el
borato se encuentre desplazado hacia la formación del borato.
El boro presente en el agua en forma de borato (procedente de la disociación del
ácido bórico) es eliminado por la membrana de ósmosis inversa, al no disponer de
hidrógenos ácidos y tener carga. El boro, en forma de borato, no es capaz de formar
enlaces con los grupos activos de las membranas mediante puentes de hidrógeno, por lo
que no la atraviesa.
Por tanto, una vez formados los boratos, el agua puede ser tratada mediante
ósmosis inversa consiguiéndose un rechazo muy elevado del boro.
78](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-99-320.jpg)






![2. Introducción
• Intercambiadores aniónicos de base fuerte y débil.
• Adsorción por alúmina activada.
• Resinas especiales.
Intercambiadores catiónicos de ácido fuerte o débil
Los intercambiadores catiónicos de ácido fuerte operan en un amplio rango de
pH. El grupo funcional de este tipo de intercambiadores es un grupo sulfonado (SO3-).
Son fuertemente ácidos cuando están ionizados a través de todo el rango de pH (1 a
14).
La capacidad de las resinas catiónicas débiles depende del pH de la disolución
que se está tratando. Presentan una mayor capacidad cuando se emplean disoluciones
neutras o alcalinas, aumentando la capacidad a medida que aumenta el pH. Su grupo
funcional suele ser un carboxilato (pKa=4,8), no encontrándose ionizado a pH bajo.
Intercambiadores aniónicos de base fuerte o débil
Una de las principales aplicaciones de los intercambiadores aniónicos de base
fuerte, en el tratamiento de aguas potables, es la eliminación de nitratos. En este caso el
grupo funcional más empleado es la amina cuaternaria [-N+(CH3)3]. Al ser fuertemente
básico, está ionizado y actúa en un rango de pH de 0 a 13.
Las resinas de intercambio aniónico de base débil presentan una mayor
capacidad cuando se tratan disoluciones ácidas, donde las aminas primarias,
secundarias o terciarias están protonadas y actúan cargadas positivamente para los
aniones.
85](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-106-320.jpg)


![2. Introducción
K=
[RA ][B ]
+ +
[RB ][A ]
+ +
(2.42)
[ ] [ ]
Donde A + y B + son las concentraciones de los iones A y B en la disolución
y [RA ] y [RB ] las de los iones A y B en la resina.
+ +
Puesto que la solución y el sólido permanecen eléctricamente neutros durante el
proceso de intercambio se puede escribir:
q C0 − C *
K= (2.43)
q0 − q C *
Siendo
C0= concentración inicial de A+ en la solución.
C* = concentración de A+ en la solución en el equilibrio con la concentración de
A en la resina.
q = concentración de A en la resina en el equilibrio.
q0 = concentración de A en la resina si todo el A+ remplazase al B+.
Capacidad de intercambio de la resina
La capacidad intercambio es el número de cargas fijadas por unidad de volumen
o peso de la resina.
La capacidad de cambio iónico se puede expresar de varias formas. La
capacidad total es el número total de sitios utilizables para el cambio. Se determina
después de convertir la resina, por regeneración química, a una forma iónica dada. Una
vez hecho esto, el ion puede eluirse de una cantidad de resina concreta y determinarse
cuantitativamente en la solución resultante. La capacidad total puede expresarse en base
al peso seco, peso húmedo o volumen húmedo de resina.
88](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-109-320.jpg)






![2. Introducción
borato es acomplejado por dos grupos sorbitol y un protón es retenido por una amina
terciaria, mediante un mecanismo de intercambio aniónico en base débil.
La reacción se produce siguiendo el siguiente mecanismo (Simonnot y col.,
1999):
• Disociación del ácido bórico:
B (OH )3 ↔ [B (OH ) 4 ] + H +
−
• Formación del complejo de boro
B (OH ) − + 2 − CHOH − CHOH ↔ 4 H 2O +
4 (2.44)
• Protonación de la amina:
− CH 2 − N (CH 3 ) − CH 2 − + H + ↔ −CH 2 + N + H (CH 3 ) − CH 2 − (2.45)
Figura 2.32. Mecanismo de la reacción de captación de boro (Marston, 2005).
95](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-116-320.jpg)

![2. Introducción
De la misma forma, haciendo notar que P=1-A, la ecuación 2.47 se puede
reescribir como:
P0 (1 − P )
ln = k (t 0 − t ) (2.48)
P (1 − P0 )
Por definición, se denomina τ al tiempo necesario para que la concentración de
boro en el agua de salida corresponda a la mitad de la del agua de entrada 2.48 se podría
expresar como:
1
P= (2.49)
1 + exp[k (τ − t )]
y despejando t
1 ⎛ P ⎞
t =τ + ln⎜ ⎟ (2.50)
k ⎝1− P ⎠
La fracción de boro (P) que pasa a través de la resina es igual a C/C0. Siendo C
la concentración de boro en la solución acuosa a la salida de la resina y C0 la
concentración de boro del alimento. Por tanto la Ec. 2.40 se puede reescribir como:
1 ⎛ C ⎞
t =τ + ln⎜ ⎟ (2.51)
k ⎜ C0 − C ⎟
⎝ ⎠
De acuerdo con la ecuación 2.51 se puede representar el tiempo t frente a
Ln[C /(C0 − C )] pudiéndose obtener, a partir de la representación, el valor de τ y 1/k
respectivamente. Alternativamente, τ puede ser obtenida del tiempo de adsorción
cuando Ln[C /(C0 − C )] =0 ya que por definición τ es el tiempo de adsorción cuando
C=1/2C0.
Acordando que el lecho de resina puede ser totalmente saturado a 2τ, la cantidad
de boro retenido por la resina (We) se calcularía (Yilmaz y col., 2005):
97](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-118-320.jpg)
































![4. Materiales y procedimiento operativo
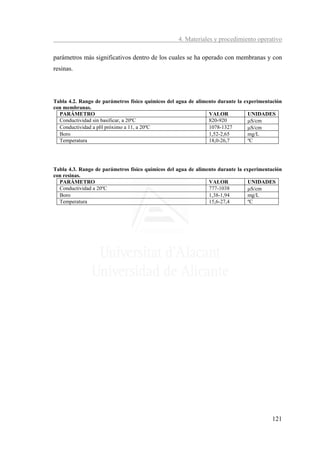
4.5. CÁLCULOS
4.5.1. Ósmosis inversa
El flujo de permeado a través de la membrana se calcula a partir de los caudales
experimentales de permeado y del área de membrana que indica el fabricante.
Jpermeado (Flujo de permeado (m3/día/m2)) = (caudal de permeado)/(área de la membrana)
(4.1)
El porcentaje de rechazo de boro por la membrana debe considerar que la
concentración de este elemento aumenta progresivamente a lo largo del tubo de presión.
Para simplificar dicho cálculo, se toma como concentración a lo largo de la membrana
una media entre la concentración del alimento y de la salmuera (Rodríguez y col. 2001;
Quin y col, 2005).
% rechazo de boro = (1-[B]permeado/(([B]alimento+[B]rechazo)/2))*100 (4.2)
El porcentaje de rechazo de sodio por la membrana se ha realizado, de igual
manera, atendiendo a la consideración anterior, se toma como concentración a lo largo
de la membrana una media entre la concentración del alimento y de la salmuera.
% rechazo de sodio = (1-[Na]permeado/(([Na]alimento+[Na]rechazo)/2))*100 (4.3)
131](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-152-320.jpg)
![4. Materiales y procedimiento operativo
4.5.2. Intercambio iónico
El volumen de agua tratada en el proceso de intercambio iónico se ha referido al
volumen de lecho empleado en el proceso, con el fin de poder analizar los resultados
obtenidos en los diferentes ensayos y poder comparar los mismos.
V= Vagua tratada/Vlecho de resina (4.4)
A partir de los datos obtenidos experimentalmente, se ha representado, de forma
gráfica, el tiempo, t, frente a Ln[C /(C0 − C )] , pudiéndose obtener, a partir de dicha
representación, el valor del coeficiente de distribución y el tiempo de rotura.
La capacidad de saturación de la resina, en las condiciones específicas de
trabajo, se ha calculado mediante la ecuación 2.52.
We = 1 Ce F (2τ ) = Ce Fτ
2 (2.52)
4.5.3. Costes económicos
Los datos presentados en los resultados se muestran en €/m3 producido. En la
bibliografía consultada los costes económicos vienen expresados en $/m3.
Para poder llevar a cabo la conversión de divisas y comparar resultados, se han
consultado los valores históricos del cambio $/€. Los datos se muestran en la figura 4.1
y han sido obtenidos del Banco Central Europeo.
132](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-153-320.jpg)



























![5. Resultados y discusión
gradiente de la concentración, resultando prácticamente despreciable el flujo asociado al
gradiente de presiones, ya que la membrana muestra un elevado valor de coeficiente de
reflexión para el sodio.
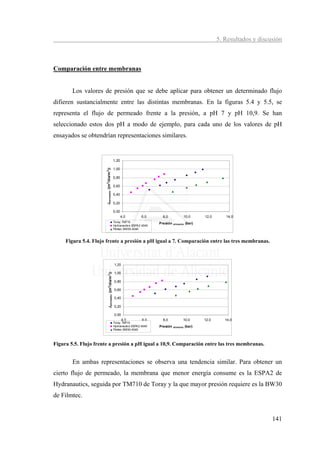
Con el fin de calcular el valor del coeficiente de permeabilidad del sodio, se ha
representado Cp frente a 1/Jv. En la figura 2.21 se muestran las curvas correspondientes
y en la tabla 5.9 los valores de Ps calculados.
1,00
0,90 6,2
0,80 7
[Na]permeado (mol/L)
0,70 7,5
0,60 7,9
0,50
8,5
0,40
9,5
0,30
10
0,20
0,10 10,5
0,00 10,9
0,8 1,0 1,2 1,4 1,6 1,8 2,0
1/Jpermeado (m 2/(m 3/día))
Figura 5.21. Cp de sodio frente a 1/Jv. Toray TM 710.
Tabla 5.9. Cp frente a 1/Jv. y valor de PNa Toray TM 710.
pH Ecuación PNa*106(m/s) r2 t (ºC)
6,2 C p = 0,064 / J v − 0,0145 0,080 0,6278 25,2
7,0 C p = 0,056 / J v − 0,0133 0,069 0,4188 24,6
7,5 C p = 0,0512 / J v − 0,0116 0,064 0,6008 24,9
7,9 C p = 0,0298 / J v − 0,0231 0,036 0,8967 24,8
8,5 C p = 0,0265 / J v + 0,0577 0,033 0,6096 24,8
9,5 C p = 0,0286 / J v + 0,0466 0,034 0,6602 24,9
10,0 C p = 0,0194 / J v + 0,0746 0,019 0,7258 24,7
10,5 C p = 0,0194 / J v + 0,0895 0,022 0,3033 25,1
Con el fin de comprobar la influencia del pH en el coeficiente de permeabilidad
se ha realizado la gráfica de la figura 5.22. Se ha despreciado el resultado obtenido a pH
10,9 por mostrar un comportamiento anómalo.
161](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-182-320.jpg)

![5. Resultado y discusión
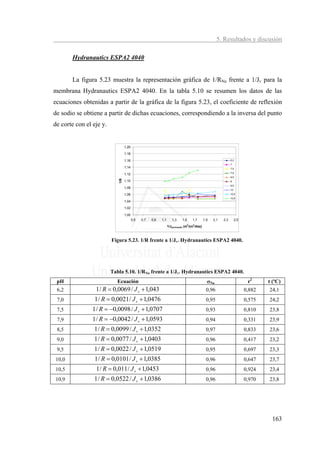
El valor del coeficiente de reflexión se mantiene prácticamente constante,
pudiéndose establecer un valor medio de 0,96. La membrana Hydranautics ESPA2 4040
presenta un menor coeficiente de reflexión que la membrana anterior. El flujo de sodio
que la atraviesa se ve influido en una pequeña proporción por el gradiente de presiones
además de por el gradiente de la concentración.
Para calcular el valor del coeficiente de permeado de sodio, se ha representado
Cp frente a 1/Jv. En al figura 5.24 se muestran las curvas correspondientes y en la tabla
5.11 los valores de Ps calculados (despreciando algunos puntos considerados anómalos)
y en la tabla 5.11 los valores de Ps.
1,00
0,90
0,80 6,2
[Na]permeado (mol/L)
0,70 7
7,5
0,60
7,9
0,50 8,5
0,40 9
0,30 9,5
10
0,20 10,5
0,10 10,9
0,00
0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4
2 3
1/Jpermeado (m /(m /día))
Figura 5.24. Cp de sodio frente a 1/Jv. Hydranautics ESPA2 4040.
164](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-185-320.jpg)


![5. Resultados y discusión
Tabla 5.12. 1/RNa frente a 1/Jv. Filmtec BW30 4040.
pH Ecuación σNa r2 t(ºC)
6,2 1 / R = 0,0073 / J v + 1,0043 1,00 0,902 22,6
7,0 1 / R = 0,0012 / J v + 1,0098 0,99 0,552 23,4
7,5 1 / R = 0,003 / J v + 1,0049 1,00 0,868 23,5
7,9 1 / R = 0038 / J v + 1,0035 1,00 0,949 23,1
8,5 1 / R = 0,0027 / J v + 1,0065 0,99 0,308 23,5
9,0 1 / R = 0,0041 / J v + 1,0069 0,99 0,918 23,5
9,5 1 / R = 0,0039 / J v + 1,0063 0,99 0,764 22,6
10,0 1 / R = 0,0023 / J v + 1,0081 0,99 0,976 23,3
10,5 1 / R = 0,0052 / J v + 1,0052 0,99 0,921 23,1
10,9 1 / R = 0,0036 / J v + 1,0129 0,99 0,677 22,3
Como en el caso de la membrana de Toray, el coeficiente de reflexión de sodio
no depende del pH de trabajo y su valor es muy próximo a 1. El flujo de sodio a través
de la membrana Filmtec BW30 4040 es, por tanto, debido prácticamente en su totalidad
al gradiente de la concentración, resultando despreciable el flujo volumétrico.
Para calcular el valor del coeficiente de permeado de sodio, se ha representado
Cp frente a 1/Jv. En al figura 2.27 se muestran las curvas correspondientes y en la tabla
5.13 los valores de Ps calculados.
.
1,00 6,2
0,90
7
0,80
[Na]permeado (mol/L)
0,70 7,5
0,60 7,9
0,50
8,5
0,40
0,30 9
0,20 9,5
0,10
10
0,00
0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 10,5
2 3
1/Jpermeado (m /(m /día)) 10,9
Figura 5.27. Cp de sodio frente a 1/Jv. Filmtec BW30 4040.
167](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-188-320.jpg)




![5. Resultado y discusión
A partir de los valores de σB calculados se ha hecho una representación gráfica
en la que se muestra este valor en función del pH. El resultado se muestra en la figura
5.30. Cabe señalar que se han despreciado los resultados obtenidos a pH 9 por mostrar
una tendencia contraria al resto de los experimentos.
1,00
0,90
0,80
0,70
0,60
0,50
σ
0,40
0,30
0,20
0,10
0,00
6 7 8 9 10 11 12
pH
Figura 5.30 Coeficiente de reflexión de boro frente al pH. Toray TM 710.
Se observa por tanto un aumento del coeficiente de reflexión de boro al
aumentar el pH en concordancia con los trabajos realizados por Hyung y Kim (2006).
Con el fin de calcular el valor del coeficiente de permeabilidad del boro, se ha
representado Cp frente a 1/Jv. En la figura 5.31 se muestra el resultado obtenido y en la
tabla 5.16 los valores de Ps
0,40
6,2
7
[B]permeado (mol/L)
0,30 7,5
7,9
0,20 8,5
9,5
0,10 10
10,5
0,00 10,9
0,8 1,0 1,2 1,4 1,6 1,8 2,0
1/Jpermeado (m 2/(m 3/día))
Figura 5.31. Cp de boro frente a 1/Jv. Toray TM 710.
172](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-193-320.jpg)


![5. Resultados y discusión
A partir de los valores de σB calculados se ha hecho una representación gráfica
en la que se muestra este valor en función del pH al que se ha trabajado. El resultado se
muestra en la figura 5.34.
1,00
0,90
0,80
0,70
0,60
0,50
σ
0,40
0,30
0,20
0,10
0,00
6 7 8 9 10 11 12
pH
Figura 5.34. Coeficiente de reflexión de boro frente al pH. Hydranautics ESPA2 4040.
Como ha ocurrido con la membrana de Toray se aprecia un aumento del
coeficiente de reflexión de boro al aumentar el pH.
Para calcular el valor del coeficiente de permeado de boro, se ha representado Cp
frente a 1/Jv. En al figura 5.35 se muestra el resultado obtenido y en la tabla 5.18 los
valores de Ps.
0,40
6,2
7
[B]permeado (mol/L)
0,30 7,5
7,9
0,20 8,5
9
0,10 9,5
10
0,00 10,5
0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 10,9
2 3
1/Jpermeado (m /(m /día))
Figura 5.35. Cp de boro frente a 1/Jv. Hydranautics ESPA2 4040.
175](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-196-320.jpg)


![5. Resultado y discusión
A partir de los valores de σB calculados se ha hecho una representación gráfica
en la que se muestra este valor en función del pH al que se ha trabajado. El resultado se
muestra en la figura 5.38.
1,00
0,90
0,80
0,70
0,60
0,50
σ
0,40
0,30
0,20
0,10
0,00
6 7 8 9 10 11 12
pH
Figura 5.38. Coeficiente de reflexión de boro frente al pH. Filmtec BW30 4040.
El valor del coeficiente de reflexión de la membrana Filmtec es superior al de las
membranas anteriores, apreciándose variaciones con el pH, pero inferiores a los dos
casos anteriores.
Para calcular el valor del coeficiente de permeado de boro, se ha representado Cp
frente a 1/Jv. En la figura 5.39 se muestra el resultado obtenido y en la tabla 5.20 los
valores de Ps.
0,40
[B]permeado (mol/L)
0,30
6,2
7
0,20
7,5
7,9
0,10 8,5
9
0,00 9,5
0,8 1,0 1,2 1,4 1,6 1,8 2,0 10
1/Jpermeado (m 2/(m 3/día)) 10,5
10,9
Figura 5.39. Cp de boro frente a 1/Jv. Filmtec BW30 4040.
178](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-199-320.jpg)


![5. Resultados y discusión
resultados entre 0,970 y 0,999 y para la permeabilidad de entre 0,06*10-6 m/s y 0,61*10-
6
m/s. En sus ensayos se observa la influencia del pH en ambos parámetros, obteniendo,
al igual que en el presente trabajo, un aumento del coeficiente de reflexión al aumentar
el pH. Por otra parte, también se puede apreciar, como se ha mostrado en los resultados
presentados, como a pH en torno a 8 la permeabilidad para el boro aumenta para luego
descender.
Transporte de ácido bórico y borato a través de la membrana
En la mayoría de la bibliografía de referencia se calcula el coeficiente de
reflexión y el coeficiente de permeabilidad del boro conforme se ha realizado en el
apartado anterior (Taniguchi y col., 2001, Sagiv y col., 2004, Ballet y col., 2004, Hyung
y Kim., 2006). Se considera el boro como tal, como boro elemental, que es la especie
analizada, sin tener en cuenta las particularidades que presenta en el agua (apartado 2.1).
Pero es importante señalar que el boro, presente en el agua, se encuentra
mayoritariamente en forma de ácido bórico en equilibrio con borato. Las variaciones de
pH conllevan una variación en la proporción en la que se encuentran estas dos especies
(figura 2.2). El cálculo del coeficiente de reflexión de boro y de permeabilidad se
debería llevar a cabo teniendo en cuenta esta disociación, estableciéndose por un lado la
influencia del pH en la presencia de ácido bórico o borato y por otro lado la influencia
del pH en los parámetros cinéticos de la membrana.
De acuerdo con lo establecido por Hyung y Kim (2006) podríamos reescribir los
coeficientes de reflexión y permeabilidad según:
PB = α B ( OH )3 PB (OH )3 + α B ( OH ) − PB ( OH ) − [LT-1] (5.8)
4 4
σ B = α B (OH ) σ B (OH ) + α B (OH ) σ B (OH )
3 3
− − (5.9)
4 4
181](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-202-320.jpg)
![5. Resultado y discusión
Siendo α B ( OH )3 y α B (OH ) − los coeficientes de reparto de cada uno de los
4
compuestos, de forma que:
α B (OH ) =
[B(OH )3 ]
[B(OH )3 ] + [B(OH )− ]
3
(5.10)
4
α B (OH )
[B(OH ) ] −
[B(OH ) ] + [B(OH ) ]
− = 4
−
(5.11)
4
3 4
α B (OH ) + α B (OH ) = 1
3
− (5.12)
4
La constante de equilibrio de la disociación del ácido bórico se define como
KB =
[B(OH ) ][H ]−
4
+
siendo pKB=9,15 (5.13)
[B(OH )3 ]
Sustituyendo las ecuaciones 5.10 y 5.11 en la 5.13 obtenemos la relación entre la
proporción de ambas especies y el pH que se representó en la figura 2.2.
α B (OH ) α B (OH )
log 3
= 9,15 − pH o lo que es lo mismo = 10 9,15− pH 3
(5.14)
α B (OH )
−
4
α B (OH ) −
4
A partir de esta relación podemos definir coeficientes de reparto de cada uno de
los compuestos ( α B (OH )3 y α B (OH ) − ) en función del pH.
4
10 9,15− pH
α B (OH ) = (5.15)
3
1 + 10 9,15− pH
1
α B (OH ) = − (5.16)
4
1 + 10 9,15− pH
Sustituyendo los coeficientes de reparto, las ecuaciones del coeficiente de
rechazo y de permeabilidad quedarían:
182](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-203-320.jpg)
![5. Resultados y discusión
10 9,15− pH 1
PB = 9 ,15− pH
PB (OH )3 + P − [LT-1] (5.17)
1 + 10 1 + 10 9,15− pH B ( OH ) 4
10 9,15− pH 1
σB = 9 ,15− pH
σ B (OH )3 + σ − (5.18)
1 + 10 1 + 10 9,15− pH B (OH ) 4
De esta forma estaría contemplada la influencia del pH debido a la disociación
del ácido bórico en borato.
En una primera aproximación y en concordancia con las propuestas de Hyung y
Kim, se consideraron PB (OH )3 , PB ( OH ) − , σ B (OH )3 y σ B ( OH ) − constantes para calcular los
4 4
valores de PB y σ B . Para el ácido bórico se tomaron los valores correspondientes a pH
6,2 (por ser el pH más bajo al que se ha trabajado y teniendo un porcentaje teórico para
esta especie del 99,88%) y para el borato se adoptaron los valores a pH 10,9 (con un
99,98% de presencia de borato). Los resultados de PB y σ B obtenidos mediante esta
aproximación no se ajustaron a los datos calculados a partir de los parámetros
experimentales y que se han reflejado en el apartado del transporte de boro. Por todo
esto, la interpretación de Hyung y Kim (2006) no resulta suficiente para establecer la
influencia del pH en la constante de reflexión y en el coeficiente de permeabilidad.
Para intentar mejorar las correlaciones de Hyung y Kim, se propone considerar
la influencia del pH en los valores PB (OH )3 , PB ( OH ) − , σ B (OH )3 y σ B ( OH ) − .
4 4
Para calcular la influencia del pH en cada caso se han utilizado los datos de PB y
σ B obtenidos en el apartado del transporte de boro. Tanto para el ácido bórico como
para el borato, se han considerado los datos correspondientes a valores de pH en los que
cada especie se encuentra en un porcentaje superior al 90%. De esta forma se dispone
de, al menos, tres datos, tanto para el ácido bórico como para el borato. En cada caso se
supone una dependencia lineal. Para el ácido bórico se han considerado valores de pH
entre 6,2 y 7,5, mientras que en el caso del borato se han seleccionado los valores de pH
entre 10 y 10,9.
183](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-204-320.jpg)









0,80
0,60
0,40
0,20
0,00
7,0 8,0 9,0 10,0 11,0 12,0
pH
Figura 5.47. Concentración de boro del permeado en función del pH del agua de alimento. Toray
TM 710.
Se observa, de forma experimental, como la reducción de boro a valores
próximos a 0,5 mg/L se obtiene a pH del orden de 9,8. Elevándose el pH a valores
próximos a 11 se consigue reducir el boro a valores inferiores al LOD.
Los valores de pH anteriormente citados se establecerán como pauta de trabajo,
para próximos ensayos.
Hydranautics ESPA2-4040
En la figura 5.48 se muestran los resultados obtenidos la membrana
Hydranautics ESPA2-4040. Los ensayos han sido realizados en un intervalo de
temperaturas de 20,6ºC-21,5ºC.
192](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-213-320.jpg)
![5. Resultados y discusión
1,40
1,20
1,00
[B] (mg/L)
0,80
0,60
0,40
0,20
0,00
6,8 7,8 8,8 9,8 10,8 11,8
pH
Figura 5.48. Concentración de boro del permeado en función del pH del agua de alimento.
Hydranautics ESPA2-4040.
Como en el caso anterior, la reducción de boro a valores próximos a 0,5 mg/L se
obtiene a pH del orden de 9,8. A valores próximos a 11 se consigue reducir el boro a
valores inferiores al LOD. Estos valores de pH se establecen como pauta de trabajo,
para próximos ensayos.
Filmtec BW30-4040
En la figura 5.49 se presentan los resultados obtenidos para la membrana Filmtec
BW30-4040. Los ensayos han sido realizados en un intervalo de temperaturas de 16,7-
19,9 ºC.
1,60
1,40
1,20
1,00
[B] (mg/L)
0,80
0,60
0,40
0,20
0,00
6,8 7,8 8,8 9,8 10,8 11,8
pH
Figura 5.49. Concentración de boro del permeado en función del pH del agua de alimento. Filmtec
BW30-4040.
193](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-214-320.jpg)







![5. Resultados y discusión
5.1.4. Evolución del rendimiento de la membrana trabajando en forma
continua a pH elevado
Con el fin de evaluar el rendimiento de las membranas cuando operan durante
largo tiempo en condiciones de pH elevado, que son las que se exigen para la reducción
de boro, se ha trabajado con una de las membranas durante nueve meses de forma
continuada. Para llevar a cabo el presente ensayo se seleccionó la membrana Filmtec
BW30 4040. Los ensayos han sido realizados dentro de un intervalo de temperaturas
entre 18,0-26,7 ºC.
Para llevar a cabo el proceso, se ha establecido como pH del mismo 10 y una
conversión del 15%. Las figuras 5.54 y 5.55 presentan respectivamente el valor de la
concentración de boro en el alimento y permeado respecto al tiempo, y el porcentaje de
rechazo de boro respecto al tiempo. En la figura 5.54 se ha añadido el dato de la
temperatura.
2,50 30,0
2,00 25,0
20,0
[B] (mg/L)
1,50
T(ºC)
15,0
1,00
10,0
0,50 5,0
0,00 0,0
0 2000 4000 6000 8000
[B]Perm (mg/L) Tiempo (h)
[B]alim (mg/L)
Temperatura alimento ºC
Figura 5.54. Concentración de boro del alimento y permeado y temperatura. Filmtec BW30.
100
95
% Rechazo B
90
85
80
0 1000 2000 3000 4000 5000 6000 7000
Tiempo (h)
Figura 5.55. Porcentaje de rechazo de boro. Filmtec BW30.
201](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-222-320.jpg)
![5. Resultado y discusión
El comportamiento de la membrana es el esperado. Se han medido
concentraciones de boro muy próximas al LOD o por debajo del mismo. Para el
porcentaje de rechazo más bajo calculado, la concentración de boro en el permeado era
de 0,09 mg/L.
En la figura 5.54 se observa un aumento progresivo de la concentración de boro
del agua de alimento a la planta piloto, por ese motivo se ha incluido dentro de la
gráfica la temperatura. Se puede apreciar como al mismo tiempo se produce el aumento
de temperatura. Por tanto, el aumento de la concentración de boro del agua procedente
de la desaladora de agua de mar podría ser debido al aumento de la temperatura.
En la figura 5.55 se observan dos zonas en las que el porcentaje de rechazo de
boro es menor, ambas corresponden al momento de arranque de la planta.
Posteriormente el proceso se estabiliza presentando porcentajes de rechazo de boro
cercanos al 100%.
De la misma forma, con el fin de comprobar si al trabajar a pH elevados durante
este tiempo ha causado deterioro de las membranas, se ha representado la concentración
de sodio en el alimento y permeado respecto al tiempo (Fig. 5.56) y el porcentaje de
rechazo de sodio respecto al tiempo (Fig. 5.57).
250
200
[Na] (mg/L)
150
100
[Na]Perm (mg/L)
50 [Na]alim (mg/L)
0
0 2000 4000 6000 8000
Tiempo (h)
Figura 5.56. Concentración de sodio del alimento y permeado. Filmtec BW30.
202](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-223-320.jpg)



![5. Resultado y discusión
5.2.1. Estudio de la eliminación de boro
Amberlite IRA 743
El volumen de resina empleado ha sido de 10,25 L. El caudal de agua a través de
la resina ha sido de 160 L/h, es decir 15,6 BV/h (volúmenes de agua por volumen de
lecho por hora). La concentración del boro del agua de alimento se encuentra entre 1,38
y 1,45 mg/L. Los ensayos han sido realizados durante la primavera, el intervalo de
temperaturas fue de 20,7 a 22,7 ºC.
La figura 5.58 muestra los datos de la concentración de boro del agua de
alimento y del agua tratada frente al volumen tratado por unidad de volumen de lecho.
3,00
2,50
2,00
[B] (mg/L)
1,50
1,00
0,50
0,00
0 500 1000 1500 2000 2500
V/volum en de lecho
[B] agua tratada [B] alimento
Figura 5.58. Concentración de boro del agua de alimento y agua tratada. Amberlite IRA 743.
Los datos de la cantidad de boro retenido por litro de resina frente al volumen
tratado por unidad de volumen de lecho se representan en la figura 5.59.
206](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-227-320.jpg)
![5. Resultados y discusión
3,00
(g/L)
2,50
resina
2,00
Boro acumulado por L
1,50
1,00
0,50
0,00
0 500 1000 1500 2000 2500
V/volum en de lecho
Figura 5.59. Boro acumulado por la resina. Amberlite IRA 743.
En la figura 5.60 se muestra la curva de rotura del ensayo realizado,
representándose [B]/[B]0 frente al tiempo.
1,00
0,90
0,80
0,70
0,60
[B]/ [B] 0
0,50
0,40
0,30
0,20
0,10
0,00
0 2000 4000 6000 8000 10000
t(min)
Figura 5.60. Curva de rotura. Amberlite IRA 743.
El comienzo de la saturación de la resina se produce al cabo de haber tratado
aproximadamente 900 L/Lresina, lo que supone una retención aproximada de 1,3 g
B/Lresina .
La concentración de boro del agua tratada se mantiene por debajo de las 0,5
mg/L hasta haber tratado en torno a 1.200 L/Lresina (figura 5.58), es decir cuando la
resina ha retenido en torno a 1,5 g B/Lresina (figura 5.59)..
207](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-228-320.jpg)

![5. Resultados y discusión
Yilmaz y col. (2005) plantean el uso de esta resina para la eliminación de boro
en el tratamiento de aguas residuales. Analizan el comportamiento a diferentes flujos
(10, 20 y 30 mL/min), lechos de resina (71,6; 107,5 y 143,2 cm3), concentraciones de
boro (250, 500 y 1000 mg/L) y temperaturas (10, 20, 30 y 40ºC). Sus condiciones de
trabajo difieren mucho de las empleadas en el presente trabajo.
Purolite S 108
El volumen de resina empleado ha sido de 10,25 L. El flujo de agua a través de
la resina ha sido de 160 L/h (15,6 BV/h). La concentración de boro del agua de alimento
se encuentra entre 1,68 y 1,94 mg/L. Los ensayos fueron realizados durante el verano,
oscilando las temperaturas dentro de un rango entre 23,1 ºC y 27,4 ºC.
La figura 5.61 representa la concentración de boro del agua de alimento y del
agua tratada frente al volumen tratado por unidad de volumen de lecho. En la figura
5.62 se muestra la cantidad de boro retenido por litro de resina frente al volumen tratado
por unidad de volumen de lecho.
3,00
2,50
2,00
[B] (mg/L)
1,50
1,00
0,50
0,00
0 1000 2000 3000 4000
V/volum en de lecho
[B] agua tratada [B] alimento
Figura 5.61. Concentración de boro del agua de alimento y agua tratada. Purolite S 108.
209](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-230-320.jpg)
![5. Resultado y discusión
3,00
(g/L)
2,50
resina
2,00
Boro acumulado por L
1,50
1,00
0,50
0,00
0 1000 2000 3000 4000
V/volum en de lecho
Figura 5.62. Boro acumulado por la resina. Purolite S 108.
A partir de los datos obtenidos, se podría establecer el comienzo de la saturación
de la resina al cabo de haber tratado aproximadamente 800 L/Lresina, lo que supone una
retención de aproximadamente 1,3 g B/Lresina. La concentración de boro del agua tratada
se mantiene por debajo de las 0,5 mg/L hasta haber tratado en torno a 1.100 L/Lresina, es
decir cuando la retención de la resina es del orden de 1,6 g B /Lresina.
En estas condiciones la regeneración de la resina se debería realizar cada 51 h
(2,1 días) si se desea la ausencia total de boro y de 71 h (2,9 días) si se desea mantener
la concentración por debajo de 0,5 mg/L.
En la figura 5.63 se muestra la curva de rotura del ensayo realizado
representándose [B]/[B]0 y la temperatura frente al tiempo.
1,00 30,0
0,90
0,80 25,0
0,70 20,0
0,60
[B]/ [B] 0
T(ºC)
0,50 15,0
0,40
0,30 [B]/[B]0 10,0
0,20 T
5,0
0,10
0,00 0,0
0 5000 10000 15000
t(min)
Figura 5.63. Curva de rotura y temperatura. Purolite S 108.
210](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-231-320.jpg)
![5. Resultados y discusión
En la zona en la que la resina está prácticamente saturada y por lo tanto la
captación de boro por parte de la resina es baja, la relación [B]/[B]0 debería mantenerse
prácticamente constante. Sin embargo, se aprecian unos saltos en la relación [B]/[B]0
que coinciden con los observados en la temperatura medida. Este hecho denota la
importancia de considerar la temperatura en el proceso de captación de boro por parte
de la resina. Considerando, dentro de un intervalo concreto, el incremento de [B]/[B]0
frente al incremento de T(ºC), se observa que la variación ha sido entre un 5-8% por
cada ºC.
Teniendo en cuenta, que en la figura 5.61, no se observa esta tendencia en el
agua de alimento y sí en el agua tratada, se puede establecer, por tanto, que el
incremento de [B]/[B]0 es debido, fundamentalmente, a un aumento de la concentración
de boro en el agua tratada al aumentar la temperatura y que a mayor temperatura la
resina presenta una menor capacidad de retención del boro. Se ha observado un
aumento en la concentración de boro del agua tratada en torno a 0,12-0,14 mg/ºC.
Yilmaz y col. (2005) ha realizado ensayos para el tratamiento de aguas
residuales con la resina Amberlite IRA 743 a diferentes temperaturas (10, 20, 30 y
40ºC). Muestran una gráfica en la que se puede apreciar cómo la capacidad de
saturación de la resina disminuye al aumentar la temperatura. De la representación no se
pueden obtener datos concretos, que por otra parte no serían comparables por las
diferencias entre los tipos de ensayo realizados.
Dow XU-43594.00
El volumen de resina empleado ha sido de 10,0 L. El flujo de agua a través de la
resina ha sido de 160 L/h (15,6 BV/h). La concentración del boro del agua de alimento
se encuentra entre 1,55 y 1,75 mg/L. El rango de temperaturas de operación osciló entre
15,6 ºC y 20,9 ºC.
211](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-232-320.jpg)
![5. Resultado y discusión
La figura 5.64 representa la concentración de boro del agua de alimento y del
agua tratada frente al volumen tratado por unidad de volumen de lecho.
3,00
2,50
2,00
[B] (mg/L)
1,50
1,00
0,50
0,00
0 500 1000 1500 2000 2500 3000 3500
V/volum en de lecho
[B] agua tratada [B] alimento
Figura 5.64. Concentración de boro del agua de alimento y agua tratada. Dow XU-43594.00.
En la figura 5.65 se muestra la cantidad de boro retenido por litro de resina
frente al volumen tratado por unidad de volumen de lecho.
5,00
4,50
(g/L)
4,00
resina
3,50
Boro acumulado por L
3,00
2,50
2,00
1,50
1,00
0,50
0,00
0 500 1000 1500 2000 2500 3000 3500
V/volum en de lecho
Figura 5.65. Boro acumulado por la resina. Dow XU-43594.00.
En la figura 5.66 se muestra la curva de rotura del ensayo realizado
representándose [B]/[B]0 frente al tiempo.
212](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-233-320.jpg)
![5. Resultados y discusión
0,90
0,80
0,70
0,60
[B]/ [B] 0
0,50
0,40
0,30
0,20
0,10
0,00
0 2000 4000 6000 8000 10000 12000
t(min)
Figura 5.66. Curva de rotura. Experimento 3. Dow XU-43594.00.
De los datos obtenidos se podría establecer el comienzo de la saturación de la
resina al cabo de haber tratado aproximadamente 800 L/Lresina. La cantidad de boro
retenida por la resina es de aproximadamente 1,3 g B/Lresina.
La concentración de boro del agua tratada se mantiene por debajo de las 0,5
mg/L hasta haber tratado en torno a 1.000 L/Lresina, es decir cuando la retención de la
resina es del orden de 1,5 g B /L resina.
En las condiciones en las que se han llevado a cabo los ensayos, la regeneración
de la resina se debería realizar cada 52 h (2,1 días) si se desea la ausencia total de boro y
de 66 h (2,7 días) si se desea mantener la concentración por debajo de 0,5 mg/L.
Kabay y col. (2008) han realizado estudios empleando la resina Dow XU-
43594.00. Sus estudios han sido llevados a cabo a escala laboratorio, empleando una
columna con un altura de 10 cm y un volumen de resina de 0,5 mL. El agua a tratar
muestra una concentración de boro de 1,5 mg/L. En estas condiciones presentan
resultados en los que trabajando con un flujo de 15 BV/h detectan una aparición de boro
en el agua tratada a partir de 600 BV.
213](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-234-320.jpg)

![5. Resultados y discusión
1,00
0,90
0,80
0,70
0,60
[B]/ [B] 0
0,50
0,40
0,30 Ambelita IRA743
Purolite S108
0,20 Dow XU-431594
0,10
0,00
0 5000 10000 15000
t(min)
Figura 5.67. Curva de rotura para las tres resinas.
De la figura 5.67 se desprende la similitud de los resultados obtenidos en los tres
casos. En condiciones ideales cabría esperar que las tres curvas se aproximaran mejor a
valores de [B]/[B]0=1, lo cual supondría que se ha alcanzado la saturación total de la
resina. Pero a escala industrial esta saturación total puede ser difícil de alcanzar ya que
la capacidad de saturación de la resina va a depender de las condiciones de operación
del proceso. Las características físico-químicas del agua y el caudal de trabajo influyen
notablemente en el resultado final (Yilmaz y col., 2005).
Parámetros cinéticos
Según lo expuesto en el apartado 2.4.2.4, si la fracción de boro adsorbida por la
resina es A y la fracción de boro remanente en la solución acuosa que pasa a través de la
resina es P, la cantidad en que decrece la fracción A es proporcional al incremento de A
(Yilmaz y col., 2005):
dA
− = kAP (2.46)
dt
215](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-236-320.jpg)
![5. Resultado y discusión
La fracción de boro P que pasa a través de la resina es igual a C/C0. De acuerdo
con la ecuación 2.49 se puede representar el tiempo t frente a Ln[C /(C0 − C )] ,
pudiéndose obtener, a partir de la representación, el valor de τ y 1/k respectivamente.
Con el fin de obtener τ y k de la resina estudiada se ha representado t frente a
Ln[C /(C0 − C )] .
Además, teniendo en cuenta que el lecho de resina puede estar totalmente
saturado a 2τ, la cantidad de boro retenido por la resina (We) se calcularía:
We = 1 Ce F (2τ ) = Ce Fτ
2 (2.52)
Siendo We la capacidad de adsorción de la columna, Ce la concentración de boro
de la solución, F el flujo de líquido y τel tiempo de rotura (50%).
La figura 5.68 muestra la representación de t frente a Ln[C /(C0 − C )] con cada
una de las resinas.
8000
7000
6000
5000
t(min)
4000
3000 y = 1033,1x + 4776
y = 1380,8x + 5113,2 Amberlita IRA743
2000
y = 665,13x + 4513,2 Purolite S108
1000 Dow XU-431594
0
-2,00 -1,50 -1,00 -0,50 0,00 0,50 1,00 1,50 2,00
Ln([B]/([B] 0-[B]))
[ ]
Figura 5.68. t frente a Ln C /(C0 − C ) para las tres resinas.
216](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-237-320.jpg)

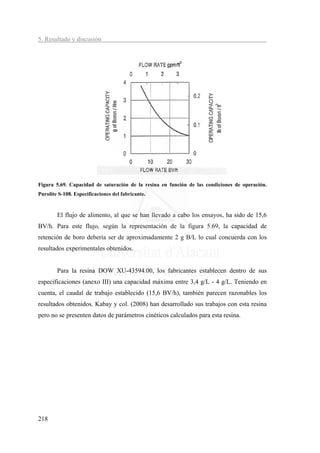
![5. Resultados y discusión
A partir de los valores de τ y k de la tabla 5.27 se puede establecer la ecuación
(2.46) que relaciona la concentración de boro en el permeado frente al tiempo de
operación (tabla 5.28).
Tabla 5.28. Concentración de boro en función del tiempo de operación.
Resina Ecuación
1
C=
Amberlite IRA 743
[
1 + exp 0,967 ⋅10 −3 (4839 − t )
* C0
]
1
C=
Purolite S108
[
1 + exp 0,724 ⋅10 −3 (5113 − t )
* C0
]
1
C=
Dow XU-43594.00.
[
1 + exp 1,503 ⋅10 −3 (4513 − t )
* C0
]
En la figura 5.70 se muestran, de forma gráfica, los resultados obtenidos de
forma experimental frente a los calculados a partir de las ecuaciones presentadas en la
tabla 5.28.
2,00
1,80
1,60
1,40
[B]producto (mg/L)
1,20
1,00
0,80 Amberlita IRA 730 experimental
Amberlita IRA 730 calculado
0,60
Purolite S108 experimental
0,40 Purolite S108 calculado
Dow XU-43594.00 experimental
0,20
Dow XU-4394.00 calculado
0,00
0 1000 2000 3000 4000 5000 6000 7000 8000 9000 10000
t (min)
Figura 5.70. Resultados experimentales y calculados de la concentración de boro en el agua tratada
frente al tiempo.
Puesto que para la obtención de los parámetros cinéticos se han utilizado
únicamente los valores próximos al punto de rotura (los valores centrales de la figura
5.67), despreciándose los valores anteriores y posteriores, en la figura 5.70 únicamente
219](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-240-320.jpg)
![5. Resultado y discusión
se ajustan los valores calculados a los experimentales en ese tramo intermedio de la
curva de rotura (Yilmaz y col., 2005).
5.2.2. Estudio de la eliminación de otros iones
Con el fin de comprobar la selectividad de la resina por el boro, se han analizado
los cationes mayoritarios en aguas: sodio, potasio, calcio y magnesio.
Los experimentos de los cuales se obtienen los datos son los mismos que los del
apartado 5.2.1. Por tanto, las condiciones de trabajo son las que se han especificado en
dicho apartado.
Con las tres resinas se han obtenido resultados muy similares, por lo que en este
apartado se muestran a modo de ejemplo los resultados obtenidos con una de las resinas.
Se ha seleccionado la resina Amberlite IRA 743 por disponerse de referencias
bibliograficas en las que se analiza la selectividad de la resina, con las que poder
comparar.
En las figuras 5.71, 5.72, 5.73 y 5.74 se presentan las concentraciones de los
diferentes iones (sodio, potasio, calcio y magnesio) del agua de alimento y del agua
tratada frente al volumen de agua tratada.
140
120
100
[Na] (mg/L)
80
60
40
20
0
0 500 1000 1500 2000 2500
V/volum en de lecho
[Na] agua tratada [Na] alimento
Figura 5.71. Concentración de sodio del agua de alimento y agua tratada. Amberlite IRA 743.
220](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-241-320.jpg)
![5. Resultados y discusión
5
4
[Mg] (mg/L)
3
2
1
0
0 500 1000 1500 2000 2500
V/volumen de lecho
[Mg] agua tratada [Mg] alimento
Figura 5.72. Concentración de magnesio del agua de alimento y agua tratada. Amberlite IRA 743.
20
18
16
14
12
[K] (mg/L)
10
8
6
4
2
0
0 500 1000 1500 2000 2500
V/volumen de lecho
[K] agua tratada [K] alimento
Figura 5.73. Concentración de potasio del agua de alimento y agua tratada. Amberlite IRA 743.
3,0
2,5
2,0
[Ca] (mg/L)
1,5
1,0
0,5
0,0
0 500 1000 1500 2000 2500
V/volumen de lechho
[Ca] agua tratada [Ca] alimento
Figura 5.74. Concentración de calcio del agua de alimento y agua tratada. Amberlite IRA 743.
Con ninguna de las resinas se observa reducción de la concentración de los
cationes analizados.
221](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-242-320.jpg)



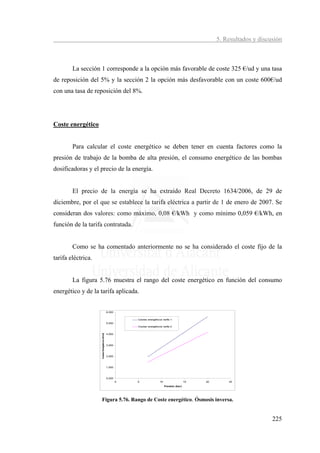


![5. Resultado y discusión
Como se puede apreciar, el pH de trabajo del proceso y el consumo energético
son dos factores muy importantes sobre el coste final del proceso. El coste podría
oscilar entre 2,82 cént€/m3 y 12,61 cént€/m3.
5.3.1.4. Comparación entre membranas
En la figuras 5.79 y 5.80 se han representado los costes de tratamiento
calculados para cada una de las membranas estudiadas en este trabajo, a partir de los
datos obtenidos experimentalmente. Para el cálculo de los costes se ha supuesto una
conversión del 85%, equivalente a la de una planta industrial. La tarifa energética
aplicada es de 0,08 €/kWh. Se presentan los dos supuestos, reducir el boro hasta 0,5
mg/L (Fig. 5.79) y reducirlo por debajo del límite de detección (Fig. 5.80).
[B]:0.5 ppm
4,01
4,50 3,62 0,02 Mantenimiento
4,00 3,06
0,02
Energia
3,50
Coste (cent €/m )
3
3,00
0,02 Reactivos
2,50 Membranas
2,49 3,22
2,00 1,93 Amortización
1,50
1,00 0,38 0,38 0,04
0,025 0,025 0,025
0,50 0,70 0,70 0,70
0,00
toray hydranautics filmtec
Figura 5.79. Comparativa de costes totales entre membranas reduciendo el boro a 0,5 mg/L.
Las diferencias de costes entre membranas son debidas a los requerimientos
energéticos y costes de reactivos para modificar el pH. Para reducir el boro a
concentraciones próximas a 0,5 mg/L la membrana que presentaría menores costes sería
la de Hydranautics, con un coste aproximados de 1 cént€ menos que la que resulta
menos económica (Filmtec). Los costes para la membrana de Hydranautics serían de
3,06 cént€/m3, para la de Toray 3,62 cént€/m3 y para la de Filmtec de 4,01 cént€/m3.
228](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-249-320.jpg)
![5. Resultados y discusión
Los costes para reducir el boro por debajo del LOD prácticamente se duplican.
En este caso, la membrana que presentaría un coste menor sería la Filmtec (ya que no
requiere elevar tanto el pH). Los costes para la membrana de Hydranautics serían de
6,77 cént€/m3, para la de Toray 7,33 cént€/m3 y para la de Filmtec de 4,63 cént€/m3.
[B]:0 ppm Mantenimiento
8,00
7,33 Energia
0,02 6,77 Reactivos
7,00 0,02
Membranas
6,00
3)
2,80 4,63
2,24
Coste (cent €/m
Amortización
5,00 0,02
4,00
3,79 3,50
3,00 3,79
2,00
1,00 0,025
0,38
0,025 0,025
0,70 0,70 0,70
0,00
toray hydranautics filmtec
Figura 5.80. Comparativa de costes totales entre membranas reduciendo el boro a por debajo del
LOD
5.3.2. Intercambio iónico
En el estudio económico del proceso de Intercambio iónico se ha tenido en
cuenta como posible variable la concentración de boro del agua de alimento. En el caso
de las membranas de ósmosis inversa no se ha analizado este dato ya que su efecto es
despreciable respecto al del valor del pH, que es el que realmente condiciona la
eliminación de boro.
5.3.2.1. Costes de implantación
Como en el proceso de membranas, el coste de implantación puede ser muy
variable, dependiendo fundamentalmente del tipo de resinas seleccionadas y del tamaño
de la instalación (factor escala). A efectos orientativos se selecciona un valor tipo de 0,8
cent $/m3 (Buch y col., 2005). Si consideremos el cambio de moneda en 1,28 $/€ (valor
promedio de febrero de 2009), el coste en euros sería de 0,62 cént€/m3.
229](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-250-320.jpg)



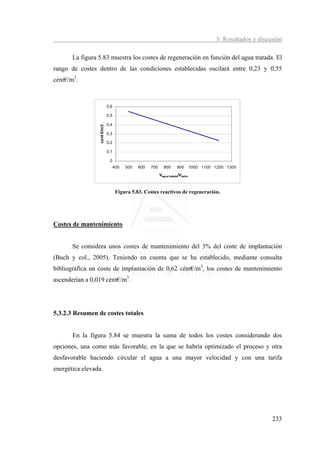
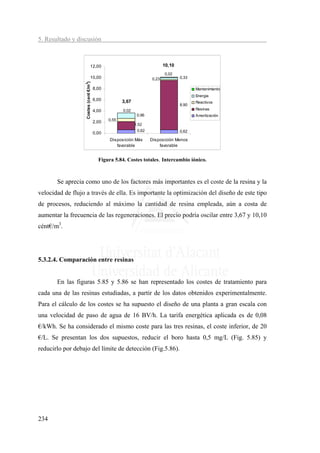
![5. Resultados y discusión
[B]:0.5 ppm
4,12 4,14 4,22
4,50 0,02
0,02 0,02
4,00 0,41
0,41 Mantenimiento
0,41
3,50 0,23 0,25 0,32 Energia
Coste (cent €/m )
3
Reactivos
3,00
resinas
2,50
Amortización
2,00 2,85 2,85 2,85
1,50
1,00
0,50
0,62 0,62 0,62
0,00
Amberlite-IRA 743 Purolite S-108 XUS-43594,00
Figura 5.85. Comparativa de costes totales entre resinas para reducir el boro a 0,5 mg/L.
[B]:0 ppm
4,45
5,00 4,20 4,24
0,02
4,50 0,02 0,02 Mantenimiento
0,41
4,00 0,41 0,41 Energia
Coste (cent €/m3)
0,30 0,34 0,55
3,50 Reactivos
3,00 resinas
2,50 Amortización
2,00 2,85 € 2,85 € 2,85 €
1,50
1,00
0,50 0,62 0,62 0,62
0,00
Amberlite-IRA 743 Purolite S-108 XUS-43594,00
Figura 5.86. Comparativa de costes totales entre resinas para reducir el boro por debajo
de LOD.
En las figura 5.85 y 5.86 se comprueba la similitud de resultados con las tres
resinas respecto al coste del proceso. Para eliminar el boro por debajo de los límites de
detección la diferencia sería del orden de los 0,25 cént€/m3. Por otra parte, no se
observan diferencias significativas entre trabajar reduciendo el boro a 0,5 o por debajo
del límite de detección. Las diferencias de costes estaría en torno a 0,1 cént€/m3.
235](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-256-320.jpg)
![5. Resultado y discusión
5.3.3. Comparación económica entre membranas y resinas
Las figuras 5.87 y 5.88 muestran, a modo de resumen, una comparativa entre las
membranas y las resinas analizadas, tanto para reducir el boro a 0,5 mg/L (figura 5.87),
como para reducirlo por debajo del LOD (figura 5.88).
[B]:0.5 ppm
4,12 4,14 4,22
4,50 4,01
3,62
4,00
3,50
Coste (cent €/m )
3,06
3
3,00
2,50
2,00
1,50
1,00
0,50
0,00
toray hydranautics filmtec Amberlite-IRA Purolite S-108 XUS-
743 43594,00
Figura 5.87. Comparativa entre membranas y resinas para reducir el boro a 0,5 mg/L.
[B]:0 ppm
8,00 7,33
6,77
7,00
Coste (cent €/m )
6,00
3
4,63 4,20 4,24 4,45
5,00
4,00
3,00
2,00
1,00
0,00
toray hydranautics filmtec Amberlite-IRA Purolite S-108 XUS-
743 43594,00
Figura 5.88. Comparativa entre membranas y resinas para reducir el boro por debajo del LOD.
Con el análisis realizado y teniendo en cuenta las limitaciones en los cálculos
que se han indicado, la eliminación de boro por debajo del LOD puede resultar menos
económica cuando se emplean membranas que resinas. Esta diferencia es debida,
236](https://image.slidesharecdn.com/tesis-boropdf228-110920144429-phpapp01/85/tesis-boro-PDF-257-320.jpg)