Uno
•Descargar como PPT, PDF•
0 recomendaciones•1,629 vistas
Denunciar
Compartir
Denunciar
Compartir
Más contenido relacionado
La actualidad más candente
La actualidad más candente (20)
Atomo, Molecula y la vida (referencia, biologia: la vida en la tierra)

Atomo, Molecula y la vida (referencia, biologia: la vida en la tierra)
Similar a Uno
Similar a Uno (20)
Clase 4 unidad 1 la materia masa, peso, peso especifico y densidad y estados ...

Clase 4 unidad 1 la materia masa, peso, peso especifico y densidad y estados ...
Último
Último (20)
el CTE 6 DOCENTES 2 2023-2024abcdefghijoklmnñopqrstuvwxyz

el CTE 6 DOCENTES 2 2023-2024abcdefghijoklmnñopqrstuvwxyz
Heinsohn Privacidad y Ciberseguridad para el sector educativo

Heinsohn Privacidad y Ciberseguridad para el sector educativo
cortes de luz abril 2024 en la provincia de tungurahua

cortes de luz abril 2024 en la provincia de tungurahua
ACERTIJO DE LA BANDERA OLÍMPICA CON ECUACIONES DE LA CIRCUNFERENCIA. Por JAVI...

ACERTIJO DE LA BANDERA OLÍMPICA CON ECUACIONES DE LA CIRCUNFERENCIA. Por JAVI...
la unidad de s sesion edussssssssssssssscacio fisca

la unidad de s sesion edussssssssssssssscacio fisca
Plan Refuerzo Escolar 2024 para estudiantes con necesidades de Aprendizaje en...

Plan Refuerzo Escolar 2024 para estudiantes con necesidades de Aprendizaje en...
Caja de herramientas de inteligencia artificial para la academia y la investi...

Caja de herramientas de inteligencia artificial para la academia y la investi...
TECNOLOGÍA FARMACEUTICA OPERACIONES UNITARIAS.pptx

TECNOLOGÍA FARMACEUTICA OPERACIONES UNITARIAS.pptx
Uno
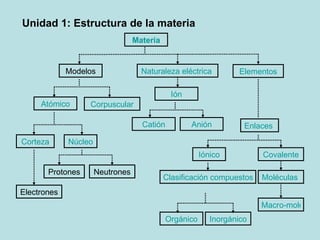
- 1. Unidad 1: Estructura de la materia Materia Naturaleza eléctrica Elementos Modelos Atómico Corpuscular Núcleo Anión Catión Ión Clasificación compuestos químicos Enlaces Covalente Iónico Inorgánico Orgánico Corteza Neutrones Protones Electrones Moléculas Macro-moléculas
- 19. Por ejemplo, compuesto iónico cloruro de sodio (NaCl), que corresponde a la sal de mesa