Atomos y emprendimiento
- 2. El atomo • Historia: modelos atómicos Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración.
- 4. Esfera • En química, el modelo de barras y esferas es un modelo molecular de una sustancia química en el que se muestra la posición tridimensional de los átomos y los enlaces entre ellos. Los átomos son típicamente representados por esferas, conectadas por las barras que representan los enlaces. Los enlaces dobles y triples son generalmente representados respectivamente por dos y tres barras curvas. En un modelo ideal, los ángulos entre las barras deberían ser los mismos entre los ángulos entre los enlaces, y las distancias entre los centros de las esferas deberían ser proporcional a las distancias correspondientes entre los núcleos atómicos. A menudo elelemento químico de cada átomo es representado por diferentes colores de de esfera. • En un modelo de barras y esferas usualmente el radio de las esferas mucho menor al tamaño de las barras con el fin de lograr un perspectiva más clara de los átomos y enlaces representados. Como consecuencia, el modelo no provee un visión clara del espacio ocupado por la sustancia. En esa perspectiva, el modelo de barras y esferas es diferente delModelo de espacio lleno, donde el radio de las esferas es proporcional al radio atómico y en la misma escala que las distancias atómicas, y por lo tanto muestran el espacio ocupado pero no los enlaces.
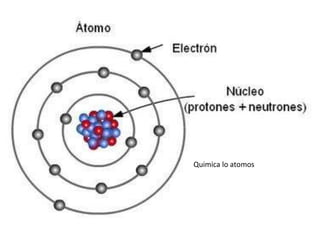
- 5. Electrones • Electron • El electrón (del griego ἤλεκτρον, ámbar), comúnmente representado por el símbolo: e−, es una partícula subatómica de tipo fermiónico. En un átomo los electrones rodean el núcleo, compuesto únicamente de protones y neutrones. • Los electrones tienen una masa de 9,11×10-31 kilogramos, unas 1800 veces menor que la de los neutrones y protones. Siendo tan livianos, apenas contribuyen a la masa total de las sustancias. Su movimiento genera la corriente eléctrica, aunque dependiendo del tipo de estructura molecular en la que se encuentren, necesitarán más o menos energía para desplazarse. Estas partículas desempeñan un papel primordial en la química, ya que definen las atracciones entre los átomos. • Desde el punto de vista físico, el electrón tiene una carga eléctrica de igual magnitud, pero de polaridad contraria a la del protón. Dicha cantidad, cuyo valor es de 1,602×10-19 coulombios, es llamada carga elemental o fundamental, y es considera a veces un cuanto de carga eléctrica, asignándosele un valor unitario. Por razones históricas y ventajas en ecuaciones matemáticas, se considera a la carga del protón como positiva, mientras que a la del electrón como negativa. Por esto se dice que los protones y electrones tienen cargas de +1 y -1 respectivamente, aunque esta elección de signo es totalmente arbitraria.
- 6. proton • El protón (del griego πρῶτον, prōton ['primero']) es una partícula subatómica con una carga eléctrica elemental positiva y una masa 1.836 veces superior a la de un electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse en otras partículas. El protón y el neutrón, en conjunto, se conocen como nucleones, ya que conforman el núcleo de los átomos. • En un átomo, el número de protones en el núcleo determina las propiedades químicas del átomo y qué elemento químico es. • El núcleo del isótopo más común del átomo de hidrógeno (también el átomo estable más simple posible) es un único protón. Al tener igual carga, los protones se repelen uno del otro, como dos imanes mirando al mismo polo. Sin embargo, pueden estar agrupados por la acción de la fuerza nuclear fuerte, que es superior a la fuerza electromagnética que los repulsa. Por tanto, el núcleo atómico puede existir sin desintegrarse por dicha repulsión. No obstante, cuando el átomo es grande (como los átomos de Uranio), a veces la repulsión electromagnética puede desintegrar el átomo progresivamente, expulsando partículas alfa, y por tanto, se trata de un átomo radiactivo; es decir, un átomo que progresivamente se convierte en un átomo de otro elemento. Estas desintegraciones pueden durar menos de un segundo, y otras pueden tardar tanto o más que la edad de Universo; por tanto, puede cuantificarse el nivel de desintegración respecto a lo que no se han desintegrado en la misma muestra, y así se puede estimar la edad de una roca (desde su formación) o planta (desde que se adhirió a la planta).
- 7. Neutron • Neutrón • • Neutrón con dos quark d y un quark u • Añadida por Henri cool • Un neutrón es un barión neutro formado por dos quarks abajo y unquark arriba. Forma, junto con los protones, los núcleos atómicos. Fuera del núcleo atómico es inestable y tiene una vida media de unos 15 minutos emitiendo un electrón y un antineutrino para convertirse en un protón. Su masa es muy similar a la del protón. • Algunas de sus propiedades: • Masa: mn = 1,675×10-27 Kg = 1,008587833 uma • Vida media: tn = 886,7 ± 1,9 s • Momento magnético: mn = -1,9130427 ± 0,0000005 mN • Carga eléctrica: 0 C. • El neutrón es necesario para la estabilidad de casi todos los núcleos atómicos (la única excepción es el hidrógeno), ya que interactúa fuertemente atrayéndose con los protones, pero sin repulsión electrostática.
- 8. Nucleo • El núcleo atómico es la parte central de un átomo, tiene carga positiva, y concentra más del 99,9% de la masa total del átomo. • Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes). La cantidad de protones en el núcleo (número atómico), determina el elemento químico al que pertenece. Los núcleos atómicos no necesariamente tienen el mismo número de neutrones, ya que átomos de un mismo elemento pueden tener masas diferentes, es decir son isótopos del elemento. • La existencia del núcleo atómico fue deducida del experimento de Rutherford, donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
- 10. Acciones