Poder calorífico 3
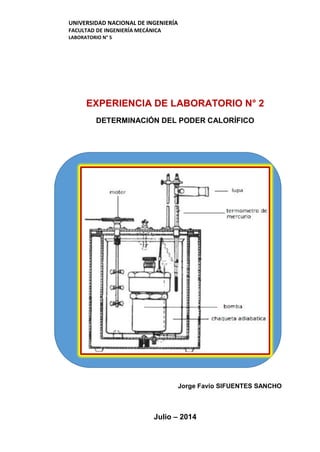
- 1. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 EXPERIENCIA DE LABORATORIO N° 2 DETERMINACIÓN DEL PODER CALORÍFICO Jorge Favio SIFUENTES SANCHO Julio – 2014
- 2. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 CONTENIDO Página 1. INTRODUCCIÓN 2. OBJETIVO 3. FUNDAMENTO TEÓRICO 4. PROCEDIMIENTO 5. ENSAYO 6. RESULTADOS 7. CONCLUSIONES 8. RECOMENDACIONES 9. CUESTIONARIO 10. MATERIAL DE REFERENCIA 11. ANEXOS
- 3. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 EXPERIENCIA DE LABORATORIO N° 2 DETERMINACIÓN DEL PODER CALORÍFICO 1. INTRODUCCIÓN En la actualidad los combustibles fósiles constituyen la principal fuente de energía primaria para la industria. Durante el proceso de combustión la energía química del combustible es transformada en energía molecular cinética o potencial de los productos. Los productos pueden producir trabajo directo o indirectamente, o actuar como almacenes de calor. El término relativo a la energía, más común, asociado con la combustión es el Valor Calorífico o Poder Calorífico. La mayoría de los combustibles contiene hidrógeno el que al quemarse produce vapor de agua. En el proceso de enfriamiento de los productos condénsase cierta cantidad de éste vapor de agua, según las condiciones. Dado que el vapor de agua libera calor al condensarse, el valor calorífico de un combustible depende de la cantidad de vapor de agua que se condensa durante el enfriamiento de los productos de combustión. Los valores caloríficos varían entre un valor mínimo (PCI), cuando no hay condensación de agua, y una valor máximo, cuando hay condensación completa (PCS). El valor calorífico obtenido sin condensación de los vapores se denomina Valor Calorífico Inferior (o neto). El valor calorífico máximo obtenido cuando la condensación de los vapores es completa, se denomina Valor calorífico superior (o bruto). Son raras las condiciones de combustión que dan lugar a uno u otro valor extremo. Cuando los productos se enfrían hasta la temperatura original, la cantidad de condensación y, por lo tanto, el valor calorífico, depende de la relación de aire-combustible original, la humedad del aire de combustión, la temperatura del aire, y la presión barométrica.
- 4. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 Con tantas variables se comprende que, para cada combustible dado, cada proceso de combustión tiene su propio valor calorífico, y debe ser determinado para condiciones dadas. Para eliminar la necesidad de usar un valor calorífico variable, se usan como valores normales los valores calorífico superior e inferior. Poder Calorífico Superior (PCS): Es la cantidad total de calor desprendido en la combustión completa de combustible, cuando el vapor de agua originado en la combustión está completamente condensado. [Kcal / kg], [Kcal / m 3]. Poder Calorífico Inferior (PCI): Es la cantidad total de calor desprendido en la combustión completa de combustible, cuando toda el agua en los productos permanece como vapor. [Kcal / kg], [Kcal / m 3 ]. Al determinarse los aumentos de temperatura resultantes de la combustión, debe usarse el poder calorífico inferior, dado que el calor latente del vapor no puede contribuir al aumento de temperatura. El rendimiento térmico, basado en el combustible, defínase como la relación del efecto útil producido por los productos de la combustión al valor calorífico del combustible. El efecto útil puede ser, por ejemplo, el calor recibido por: El fluido (aire) en una cámara de secado, el fluido recibido en una terma de agua caliente, el fluido (agua o alimentos) en una cocina. La energía química está asociada con una reacción química. Para los combustibles, se toma como energía química la que posee el combustible y que es liberada durante el proceso de combustión completa. Ésta energía es una cantidad fija para cada combustible dado, y es independiente tanto de las condiciones iniciales de la mezcla aire-combustible como de la naturaleza del proceso de combustión. La energía química que posee el combustible, y que es liberada durante la combustión; parte de ésta energía puede transformarse en trabajo, parte puede ser removida como calor de los productos, y parte puede ser poseída por estos productos. El valor calorífico es el calor que puede ser removido de
- 5. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 los productos, y no coincide por lo tanto, con la energía química, la que es energía almacenada. Sin embargo, en los raros casos en que la suma de las energías moleculares cinética y potencial es igual a la suma de las de la mezcla de aire-combustible a la temperatura dada, la energía química es numéricamente igual al valor calorífico. El calor de reacción es el calor que debe de extraerse de los productos de cualquier reacción para enfriar los productos a la temperatura original. El calor de reacción difiere del valor calorífico, en cuanto que el valor calorífico está restringido a los combustibles y se usa en relación con los procesos de combustión completa. Para la combustión completa de un combustible, el calor de reacción coincide con el valor calorífico. El calor de reacción normal es el calor de reacción en condiciones de: 20 [°C] de temperatura y 1,033 [kg/cm 2] de presión absoluta.
- 6. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 2. OBJETIVOS OBJETIVO GENERAL: Determinar el Poder Calorífico de un combustible líquido, mediante ensayo en la Bomba Calorimétrica de Emerson, en el Laboratorio N°5 UNI-FIM, para ser usado en el cálculo del rendimiento térmico de equipos y dispositivos. OBJETIVOS ESPECÍFICOS: Lograr conocimientos y pericia en el manejo del equipo e instrumentos de la Bomba Calorimétrica y reconocer que tipo de Poder Calorífico se obtiene del proceso de la combustión en la Bomba. 3. FUNDAMENTO TEÓRICO El Poder Calorífico de un combustible es la cantidad de calor que se puede obtener de un combustible cuando se quema en forma completa y sus productos son enfriados hasta la temperatura original de la mezcla aire- combustible. [Kcal/kg], [Kcal / m 3]. Figura N° 1. Poder Calorífico de un combustible Fuente: Elaboración propia Entre los productos de la combustión está presente vapor de agua, el cual, dependiendo de la temperatura de los productos, puede permanecer como vapor, puede condensar parcialmente o condensarse completamente. COMBUSTIÓN REACTIVOS PROCESO PRODUCTOS 1 g de combustible Aire GASES DE LA COMBUSTIÓN CALOR = PODER CALORÍFICO T = 25 °C T = 25 °C
- 7. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 Como el vapor al condensarse libera calor, mientras más condensado se forme, mayor calor se estará obteniendo del combustible. Esto permite diferenciar entre Poder Calorífico Superior y Poder Calorífico Inferior. Poder Calorífico Superior (PCS): Es la cantidad total de calor desprendido en la combustión completa de combustible, cuando el vapor de agua originado en la combustión está completamente condensado. Poder Calorífico Inferior (PCI): Es la cantidad total de calor desprendido en la combustión completa de combustible, cuando toda el agua en los productos permanece como vapor. La diferencia entre el PCS y el PCI está dado por: PCS - PCI = Calor latente del vapor de agua. [1] de combustión a la temperatura de la mezcla original de aire-combustible. Cada combustible tiene un Poder Calorífico característico, tal como se muestra en el cuadro siguiente. Cuadro N° 1. Poder Calorífico de diferentes combustibles fósiles y su costo Combustible Densidad [kg/lt] Precio [US/Ton] PCI [Kcal/kg] PCS [Kcal/kg] Precio [US$/MMBTU] PCS Precio [US$/MMKcal] PCS Gas Licuado 0,56 784,97 10 734 11 660 16,98 67,34 Diésel 0,85 666,89 10 165 10 900 15,49 61,34 PC N° 5 0,95 410,95 9 762 10 340 10,06 39,90 PC N° 6 0,98 330,89 9 625 10 150 8,22 32,60 Carbón 120,00 6 250 6 500 4,66 18,46 Gas Natural 0,62 8 100 9 000 6,00 23,80 Electricidad Industrial AT4.3 Monómico 0,071 [US$/kW h] 0,071 [US$/kW h] 20,80 82,60 Fuente: Termoeléctrica que usa Gas Natural de Atacama Los valores del Poder Calorífico pueden cambiar dependiendo de diversos factores, como el lugar de origen del combustible, la materia prima usada para obtenerlas, el proceso utilizado para su obtención, entre otros. Debido a esto, son muy importantes las mediciones del Poder Calorífico de los combustibles, para lo cual puede usarse un equipo conocido como Bomba Calorimétrica.
- 8. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 BOMBA CALORIMÉTRICA DE EMERSON La Bomba Calorimétrica se usa para determinar el Poder Calorífico de un combustible cuando se quema a volumen constante. Una determinada cantidad de combustible (mc), cuyo Poder Calorífico (PC) se desea determinar, se coloca en el crisol para combustible (Si el combustible es sólido, deberá colocarse en forma de pastilla) dentro de la bomba. Adicionalmente se agrega el oxígeno necesario para la combustión y la mezcla aire-combustible se lleva hasta su temperatura de ignición. La combustión del combustible nos da un calor Q. Q = mc x PC = c x c x PC [2] Donde: Q: es el calor cedido por 1 [cm 3 ] de combustible. c. Es el volumen de combustible, [1 cm 3 ] c. Es la densidad del combustible, a condiciones de 101,325 kPa y 25°C de temperatura. PC: es el Poder Calorífico del combustible obtenido a volumen constante, a condiciones de 101,325 kPa y 25°C de temperatura. Cabe mencionar que éste valor del Poder Calorífico a volumen constante difiere muy poco del Poder Calorífico a presión constante (1%), por lo que para cálculos de ingeniería pueden tomarse indistintamente. El calor desarrollado por la combustión, ecuación [2], es transmitida hacia un elemento fluido y hacia la bomba calorimétrica. Q = mc x PC = Qagua x Qbomba [3]
- 9. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 La bomba (donde se realiza la combustión) está sumergida en una chaqueta de agua que contiene una cantidad conocida de agua que absorberá el calor liberado por el combustible. Todo esto se realiza dentro de una camisa adiabática para evitar fuga de calor que afecte el proceso. Figura N° 2. Bomba Calorimétrica Fuente: Midiendo las diferencias de temperatura del agua antes y después de la combustión, es posible determinar el calor cedido por el combustible. Sin embargo, el calor que absorbe el agua no es Poder Calorífico del combustible, debido a diversos factores, entre los cuales pueden nombrarse: - absorción de calor por la propia bomba, - liberación de calor del alambre que provoca el encendido del combustible, - liberación de calor por la formación de ácido nítrico y sulfúrico entre otros.
- 10. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 Tomando en cuenta todos los factores nombrados y aplicando la ecuación de la energía al proceso de combustión a volumen constante, se obtiene la siguiente expresión para el cálculo del calor que recibe la bomba calorimétrica: 𝑄 = 𝑚 𝑎𝑔𝑢𝑎 𝐶𝑝 𝑎𝑔𝑢𝑎 ∆𝑇𝑎𝑔𝑢𝑎 + 𝑚 𝑏𝑜𝑚𝑏𝑎 𝐶𝑝 𝑏𝑜𝑚𝑏𝑎 ∆𝑇𝑏𝑜𝑚𝑏𝑎 − 𝐶𝑝 𝑓𝑖𝑙𝑎𝑚𝑒𝑛𝑡𝑜 ∆𝑇𝑓𝑖𝑙𝑎𝑚𝑒𝑛𝑡𝑜 𝑄 = [ 𝑚 𝑎𝑔𝑢𝑎 𝐶𝑝 𝑎𝑔𝑢𝑎 + 𝑚 𝑏𝑜𝑚𝑏𝑎 𝐶𝑝 𝑏𝑜𝑚𝑏𝑎 ] ∆𝑇 − 𝑚 𝑓𝑖𝑙𝑎𝑚𝑒𝑛𝑡𝑜 𝑃𝐶𝑓𝑖𝑙𝑎𝑚𝑒𝑛𝑡𝑜 𝑄 = 𝐾 ∆𝑇 − 𝑒2 − 𝑒1 [4] donde: K es la capacidad térmica de absorción de la bomba calorimétrica proporcionada por el fabricante, 2440 [Cal / °C]. T está dado por: T = (Tmáx - T e) + P2 - P1, [°C] [5] P2 y P1 son factores de corrección. P2 = 0,5 R2 x t2, P1 = 0,5 R1 x t1; [6] R1: Régimen de aumento de la temperatura por minuto antes del encendido, [ °C/min ]. Hay que registrar la temperatura del agua cada minuto durante cinco (05) minutos antes del encendido. Cada 30 segundos a partir del momento de encendido hasta alcanzar la temperatura máxima, y se continua midiendo cada minuto durante cinco (05) minutos.
- 11. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 R2: Régimen de disminución de temperatura después de la temperatura máxima, [°C/min ]. t1: Tiempo transcurrido desde el momento del encendido hasta alcanzar la temperatura ambiente, [ min ]. t2: Tiempo transcurrido desde la temperatura máxima a temperatura ambiente, [min]. . Igualando las ecuaciones [3] y [6], se obtiene la expresión: 𝑃𝐶 = 𝐾 . ∆𝑇 𝑚 𝑐 = 𝐾 . ∆𝑇 ∀ 𝑐. 𝜌 𝑐 [cal/g] [7] Donde: PC: Poder Calorífico del combustible, en calorías por gramo, [cal/g]. T: Obtenida de la ecuación [5], [°C]. mc: es la masa del combustible, [g] c: Volumen del combustible líquido, [1 cm 3 ] c: Densidad del combustible líquido, [g/ cm 3 ] A condiciones de 101,325 [kPa] y 25 [°C]. Éste ¨Poder Calorífico es necesario corregirlo por el calor liberado por el fusible (aproximadamente 1600 [cal/g]); por la formación de ácido nítrico (230 [cal/g] de ácido nítrico) en trabajos de menor precisión considerar 10 [cal]; por formación de ácido sulfúrico (1300 [cal/g] de azufre presente en la muestra).
- 12. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 4. PROCEDIMIENTO - Una cantidad de combustible 1 [cm 3 ] se coloca en el crisol junto con un alambre que sirve de elemento incandescente; se satura el espacio con unas cuantas gotas para la condensación completa del vapor y se arma la bomba. - Suministrar oxígeno; sumergir la bomba en agua e instalar el termómetro. - El combustible se enciende al hacer circular corriente eléctrica por el alambre y por estar la bomba llena de oxígeno 300 [psig]. - El calor desprendido del sistema a volumen constante es enfriado a su temperatura original y usando factores de corrección para condiciones de temperatura de 25 [°C] es posible obtener el Poder Calorífico: 𝑃𝐶 = 𝐾 . ∆𝑇 ∀ 𝑐. 𝜌 𝑐 [cal/g] Recomendaciones: - Contenido de agua de 1900 gramos, a temperatura menor de 3°F que la temperatura externa. - La bobina o elemento incandescente debe tocar el combustible pero no el crisol. - Accionar el agitador (3 a 4 minutos), para uniformizar. - El termómetro debe de estar sumergido 75 [mm] en el agua. - Realizar el ensayo con el objetivo siguiente:
- 13. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 5. ENSAYO: Fecha: Integrantes: Condiciones ambientales: Presión: [kPa] Temperatura [°C] Bulbo seco [°C] Bulbo húmedo Humedad: [%] A volumen constante Figura N° 3. Bomba Calorimétrica de Emerson Fuente:
- 14. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 25 [°C] 25 [°C] Tabla N°1. Datos TIEMPO T agua TIEMPO T agua TIEMPO T agua [min] [°C] [min] [°C] [min] [°C] 0 25 Tamb 0 Tenc ?? Tmax ? Tenc ?? Tmax ??? 25 Tamb Fuente: Elaboración propia t1 = ( ??? - ?) [min] = ; t2 = ( ??? - ??) [min] = 𝑅1 = 𝑇𝑒𝑛𝑐 − 𝑇𝑎𝑚𝑏 ? −0 = [° 𝐶 𝑚𝑖𝑛 ] 𝑅2 = 𝑇𝑚𝑎𝑥 − 𝑇𝑎𝑚𝑏 ? ? ? − ? ? = [° 𝐶 𝑚𝑖𝑛 ] T amb Tencendido Tmáxima Tamb R1 = [°C/min] R2 = [°C/min] t1 = [min] t2 = [min]
- 15. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 P2 = 0,5 R2 x t2 = [°C] P1 = 0,5 R1 x t1 = [°C] T = (Tmáx - T e) + P2 - P1) = [°C] También: 𝑄 = ∀ 𝑐. 𝜌𝑐 𝑃𝐶 = [Cal/g] Luego: 𝐾 = 𝑄 ∆𝑇 = [Cal/°C] Si se ensaya con un combustible líquido, su Poder Calorífico está dado por: 𝑃𝐶 = 𝐾 . ∆𝑇 ∀ 𝑐. 𝜌 𝑐 = [Cal/g]
- 16. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 A presión constante Figura N° 5. Bomba Calorimétrica Fuente: 1. Procedimiento a) Preparación del Equipo. Se toman de 1 a 1,5 gramos de combustible pulverizado y se fabrica una pastilla. Si el combustible es líquido, se toman con una pipeta de 1 a 1,5 mililitros. El combustible debe colocarse en el crisol de la bomba. El recipiente del agua se llena con 2000 a 2200 gramos de agua. Se corta un trozo de alambre de ignición de 15 cm y se ata firmemente a los electrodos de la bomba calorimétrica, asegurándose que el alambre toque el combustible. Se cierra la bomba, se presuriza con oxígeno a 20 atmósferas y se introduce en el recipiente del agua. Se introduce el recipiente dentro de la camisa adiabática y se coloca la tapa correspondiente. Bombona de Oxígeno Recipiente para el Agua Camisa Adiabática Bomba Calorimétrica Termómetro
- 17. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 b) Prueba Preliminar. Es conveniente familiarizarse con el termómetro del equipo, así como determinar su apreciación. Una vez que se haya alcanzado el equilibrio térmico entre los distintos componentes del sistema, se enciende el agitador, tomando nota cada minuto de la temperatura del agua en la bomba. Esto se hace hasta que la temperatura se estabilice o hasta que los cambios de temperatura se hagan constantes. c) Prueba Principal. Una vez logrado lo anterior, se conectan eléctricamente los electrodos de la bomba, presionando el interruptor correspondiente. En este momento el hilo de hierro se torna incandescente y se funde, formándose óxido de hierro y quemando completamente el combustible. En este momento la temperatura comienza a subir rápidamente. Las lecturas de temperatura siguen tomándose minuto a minuto hasta que se estabilice. d) Prueba Complementaria. Si luego de dar por culminada la prueba principal se aprecian algunos nuevos cambios de temperatura, estos se anotan minuto a minuto hasta verificar la estabilidad o hasta que los cambios sean constantes. Si esto no ocurre, la prueba finaliza cuando el número de lecturas sea igual al de la prueba preliminar. 2. Procesamiento de los Datos Con los datos tomados durante la práctica el estudiante deberá 1. Determinar la constante de la bomba calorimétrica para el momento del ensayo, usando las ecuaciones correspondientes y los datos obtenidos para la experiencia realizada con el combustible de poder calorífico conocido. 2. Determinar el poder calorífico de un combustible usando la constante calculada y los datos obtenidos para el ensayo con un combustible de poder calorífico desconocido. 3. Obtener información de la literatura sobre el valor del poder calorífico del combustible objeto del ensayo y compararlo con el calculado
- 18. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 experimentalmente.Realizar el análisis de los resultados anteriores y establecer las conclusiones correspondientes. TablaN° 2. Datos PRUEBA PRELIMINAR PRUEBA PRINCIPAL PRUEBA COM- PLEMENTARIA PRUEBA PRELIMINAR PRUEBA PRINCIPAL PRUEBA COM- PLEMENTARIA N° T ΔT T ΔT T T ΔT T T ΔT 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Fuente: 2 PP PmCdondeCTT CP CPRINCIPALPRUEBA ΔΔ inarlimprepruebadelécturasNúmero inarlimprepruebadesdiferenciadeSuma PP
- 19. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 ariacomplementpruebadelécturasNúmero ariacomplementpruebadesdiferenciadeSuma PC m = Número de lecturas de la prueba principal Es importante señalar que el último valor anotado para la prueba preliminar será el primero para la prueba principal y el último anotado para la principal será el primero para la complementaria. Las diferencias se calculan a través de la ecuación n-(n+1) y se colocan con el signo que resulten, no en valor absoluto.
- 20. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 6. RESULTADOS Comparar los resultados obtenidos con los datos provenientes de la literatura que están indicados en los Anexos.
- 21. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 7. CONCLUSIONES
- 22. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 8. RECOMENDACIONES
- 23. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 9. CUESTIONARIO 1. ¿Qué es el Poder Calorífico Alto (Superior)?. 2. ¿Qué es el Poder Calorífico Bajo (Inferior)?. 3. En la Bomba Calorimétrica de Emerson: se obtiene el ¿Poder Calorífico Superior o el Poder Calorífico Inferior? Porqué?. 4. ¿Qué factores deben ser considerados en cuanto a la transferencia de calor a fin de acercarnos hacia la determinación del valor calorífico?. 5. ¿Qué tipo de proceso se lleva a cabo en la Bomba Calorimétrica de Emerson?. 6. Los valores caloríficos se dan por lo general a 25 [°C]. ¿Cuál es la magnitud del efecto de la temperatura sobre los valores caloríficos (a) cuando los valores caloríficos se dan por u idad de masa; 8b) cuando se dan por unidad de volumen?.
- 24. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 10. MATERIAL DE REFERENCIA 1. Seymour Doolitle. El Laboratorio del Ingeniero Mecánico. Editorial Hispano Americana S.A. Buenos Aires 1971 2. Manual del Laboratorio de Ingeniería Mecánica. 3. Manual del Ingeniero Mecánico 4. ASME Power Test Codes, Supplements on Instruments and Apparatus: part 9, Heat of Combustion, 1943
- 25. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 11. ANEXOS ANEXO 1: OBJETIVO DEL ENSAYO ANEXO 2:
- 26. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 ANEXO 1: OBJETIVOS DEL ENSAYO OBJETIVO GENERAL OBJETIVO ESPECÍFICO Calcular el calor Q desarrollado por la Obtener la capacidad térmica de absorción combustión de 1 [cm 3] del combustible de la bomba calorímétrica, constante K, Diesel N°2 cuyo Poder Calorífico es de a partir de un combustible líquido o sólido 10 00 [Kcal/m 3] cuyo poder calorífico es conocido Calcular el parámetro T indicado en la ecuaión [3], a partir de los datos provenientes del ensayo en la Bomba Calorimétrica. Lograr conocimientos y pericia, Determinar el Poder Calorífico de un sólido en el manejo de equipo e instrumentos o un líquido, mediante un proceso de la Bomba Calorímétrica. experimental, usando para ello la Bomba Reconocer qué tipo de Poder Calorífico se Calorimétrica del Laboratorio N°5 UNI-FIM obtienen del proceso de la combustión en la Bomba Calorimétrica. 𝑄 = 𝑚 𝑐 𝑃𝐶 = ∀ 𝑐. 𝜌𝑐 . 𝑃𝐶 𝐾 = 𝑄 𝑇
- 27. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 28. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5 Marcoteórico: Para determinar el calor de combustión, se puede utilizar la bomba calorimétrica o calorímetro deParr. Este consiste en un recipiente donde está contenida la muestra y donde se realiza la combustión (bomba). La bomba está sumergida en una cantidad conocidadeagua.Elsistemacompletoestácontenidoenunachaquetaadiabáticaque impide que salga calor del sistema. Midiendo las diferencias de temperatura del agua antes y después de la combustión, es posible determinar el calor cedido por el combustible.. Setiene queelsistema es adiabático, osea
- 29. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 30. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 31. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 32. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 33. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 34. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 35. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
- 36. UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA MECÁNICA LABORATORIO N° 5
