Ing_Js.pdf
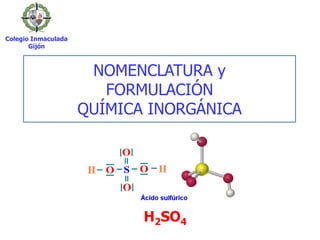
- 1. NOMENCLATURA y FORMULACIÓN QUÍMICA INORGÁNICA Colegio Inmaculada Gijón H2SO4
- 2. 0. Introducción Clasificación de los tipos de materia Sistemas materiales Sustancias puras (un solo componente) Simples Un solo tipo de átomo. Monoatómicas Na, Fe, Cr Poliatómicas O2, Cl2 Compuestas Dos o más tipos de átomos. Moleculares H 2O , CH4 , NH3 Mezclas (varios componentes) Homogénas (Ej: Disoluciones) Una sola fase: Sal+agua Alcohol+agua Heterogénas Dos o más fases: Arena+agua granito
- 5. 0. Introducción Valencia Es la capacidad que posee un elemento de combinarse con otro y formar compuestos. Número de oxidación Es el nº de electrones que un átomo puede captar (-), ceder (+) O compartir al formar enlace en un compuesto El nº de oxidación tiene signo y en muchos casos coincide con la valencia del elemento
- 6. TIPOS DE NOMENCLATURA Tradicional Nombres vulgares muy arraigados, pero con muchas excepciones. Utiliza los prefijos y sufijos: hipo_ _oso, _oso, _ico y per_ _ico Sistemática Recomendada por la IUPAC. Utiliza los prefijos: mono, di, tri, tetra, penta…. El prefijo mono puede omitirse Stock Recomendada por la IUPAC. Útil cuando existen varios números de oxidación, que se indican entre paréntesis FeO óxido ferroso Fe2O3 óxido férrico ¡muchas ya no se usan, se consideran incorrectas! FeO monóxido de hierro Fe2O3 trióxido de dihierro FeO óxido de hierro (II) Fe2O3 óxido de hierro (III)
- 7. I. Sustancias simples Aquéllas constituidas por átomos de un mismo elemento • Los gases nobles son monoatómicos: He, Ne, Ar, Kr, Xe, Rn • Hay sustancias diatómicas de gran importancia H2 , N2 , O2 , F2 , Cl2, Br2, I2 • Algunos elementos presentan diferentes estados alotrópicos (agrupaciones de distintos nº de átomos: O3 (ozono), S8 , P4… • Los metales, se representan con su símbolo: Cu, Sn, Fe, Ag, …
- 8. II. Compuestos binarios Están formados por dos elementos • Se escribe a la derecha el que en la tabla está más a la derecha en la tabla periódica (diapositiva siguiente). En segundo lugar el más electronegativo (aproximadamente) • Se escriben los símbolos • Se intercambian las valencias Al O +3 -2 2 3 • Si es posible se simplifica: Cu2S2 CuS • El compuesto se lee de derecha a izquierda Elemento valencia compuesto A a AbBa B b
- 10. II. Compuestos binarios CLASIFICACIÓN óxidos peróxidos hidruros sales neutras óxidos básicos óxidos ácidos hidruros metálicos hidruros no metálicos grupos 13, 14,15 hidruros volátiles grupos 16, 17 haluros de hidrógeno sales neutras sales volátiles
- 11. II. Compuestos binarios Cl2O5 pentaóxido de dicloro H2S sulfuro de dihidrógeno SiH4 tetrahidruro de silicio PCl5 Pentacloruro de fósforo Nomenclatura SISTEMÁTICA • Utiliza prefijos numerales griegos para indicar el nº de átomos de cada elemento presente en la fórmula mono (1), di (2), tri (3), tetra (4), penta (5), hexa (6), hepta (7), (El prefijo mono puede omitirse)
- 12. CuO óxido de cobre (II) Fe2O3 óxido de hierro (III) Al2O3 óxido de aluminio Nomenclatura de STOCK Indica la valencia, con números romanos y entre paréntesis, al final del nombre del elemento. Si el elemento tiene una sola valencia, no se indica.
- 13. Posibilidad de n. o. terminación uno -ico dos Val. menor -oso Val. mayor -ico tres Val. menor hipo -oso Val. intermedia -oso Val. mayor -ico cuatro Val. menor hipo -oso Val. intermedio -oso Val. intermedio -ico Val. mayor per -ico Nomenclatura TRADICIONAL (no se usa) Se añade un sufijo al nombre del elemento según la valencia con que actúe: FeCl2 cloruro ferroso (incorrecto): cloruro de hierro (II) FeCl3 cloruro férrico(incorrecto): cloruro de hierro(II) NaCl cloruro sódico: de sodio
- 14. 1. Hidruros (I) Son combinaciones del hidrógeno con cualquier elemento Hidruros Hidruros metálicos Hidruros no metálicos Hidruros volátiles Haluros de hidrógeno
- 15. 1. Hidruros (I) Compuesto Sistemática Stock CaH2 dihidruro de calcio hidruro de calcio LiH hidruro de litio hidruro de litio FeH3 trihidruro de hierro hidruro de hierro (III) SrH2 dihidruro de estroncio hidruro de estroncio Combinación del hidrógeno con un metal. Se recomienda la nomenclatura de STOCK. Hidruros metálicos
- 16. 2. Hidruros (II) Comp. Sistemática Stock Sus disoluciones HF fluoruro de hidrógeno fluoruro de hidrógeno ácido fluorhídrico HCl cloruro de hidrógeno cloruro de hidrógeno ácido clorhídrico HBr bromuro de hidrógeno bromuro de hidrógeno ácido bromhídrico HI yoduro de hidrógeno yoduro de hidrógeno ácido yodhídrico H2S sulfuro de dihidrógeno sulfuro de hidrógeno ácido sulfhídrico H2Se seleniuro de dihidrógeno seleniuro de hidrógeno ác. selenhídrico Hidrógeno con un no metal de los grupos 16 y 17. Se nombran como ácidos cuando están en disolución acuosa Haluros de hidrógeno
- 17. 1. Hidruros (III) Comp. Sistemática Stock Tradicional NH3 trihidruro de nitrógeno hidruro de nitrógeno (III) Amoniaco / azano PH3 trihidruro de fósforo hidruro de fósforo (III) Fosfano AsH3 trihidruro de arsénico hidruro de arsénico (III) Arsano SbH3 trihidruro de antimonio hidruro de estibina (III) Estibano CH4 tetrahidruro de carbono hidruro de carbono (IV) metano SiH4 tetrahidruro de silicio hidruro de silicio (IV) silano BH3 trihidruro de boro hidruro de boro (III) borano Hidrógeno con un no metal. Se recomienda la nomenclatura de SISTEMÁTICA. Tienen nombres comunes aceptados por la IUPAC. Hidruros volátiles
- 18. II. Compuestos binarios 2. Óxidos Compuesto Sistemática Stock PbO2 dióxido de plomo óxido de plomo (IV) FeO monóxido de hierro óxido de hierro (II) Fe2O3 trióxido de dihierro óxido de hierro (III) Li2O óxido de dilitio óxido de litio Combinaciones del oxígeno con cualquier elemento químico Óxido básico: oxígeno con un metal. Óxido ácido: es la combinación del oxígeno con un no metal SO monóxido de azufre óxido de azufre (II) SO2 dióxido de azufre óxido de azufre (IV) SO3 trióxido de azufre óxido de azufre (VI) CO2 dióxido de carbono óxido de carbono (IV)
- 19. II. Compuestos binarios 2. Óxidos (III) Comp. Sistemática Stock N2O óxido de dinitrógeno óx. de nitrógeno (I) NO óxido de nitrógeno óx. de nitrógeno(II) N2O3 trióxido de dinitrógeno óx. de nitrógeno(III) NO2 dióxido de nitrógeno -- N2O4 tetraóxido de dinitrógeno -- N2O5 Pentaóxido de dinitrógeno óx. de nitrógeno(V) El nitrógeno da 8 óxidos diferentes. Suelen representarse NOx
- 20. II. Compuestos binarios 3. Peróxidos Compuesto Nomenclatura Na2O2 peróxido de sodio CaO2 peróxido de calcio Al2O6 peróxido de aluminio H2O2 peróxido de hidrógeno (agua oxigenada) BaO2 peróxido de bario Combinación del grupo PEROXO (-O-O-) también representado O2 2- El grupo peroxo actúa con valencia 2 El oxígeno siempre debe llevar subíndice par • Se nombran: Peróxido de… seguido del nombre del metal • Se formulan: Se escribe el otro elemento, a continuación O2 y se intercambian las valencias
- 21. II. Compuestos binarios Sales binarias Compuesto Sistemática Stock LiF fluoruro de litio fluoruro de litio AuBr3 tribromuro de oro bromuro de oro (III) Na2S sulfuro de disodio sulfuro de sodio SnS2 disulfuro de estaño sulfuro de estaño (IV) Las sales se forman a partir de los ácidos, sustituyendo los hidrógenos de la molécula del ácido por otro elemento, generalmente un metal. Las sales binarias proceden de los ácidos hidrácidos (H2S, HCl, HI, HBr…) • Se nombran: Nombre del ácido terminado en –URO seguido del nombre del metal • Se formulan: Al otro elemento se le pone de subíndice el número de hidrógenos del ácido y al resto del ácido de subíndice la valencia del metal BrF3 trifluoruro de bromo fluoruro de bromo(III) BrCl cloruro de bromo cloruro de bromo(I) CCl4 tetracloruro de carbono cloruro de carbono(IV)
- 22. III. Compuestos ternarios Compuestos ternarios hidróxidos ácidos oxácidos oxisales neutras sales ácidas Están formados por átomos de tres elementos diferentes
- 23. III. Compuestos ternarios 1. Hidróxidos Comp. Sistemática Stock NaOH hidróxido de sodio hidróxido de sodio Ca(OH)2 dihidróxido de calcio hidróxido de calcio Fe(OH)3 trihidróxido de hierro hidróxido de hierro (III) Al(OH)3 trihidróxido de aluminio hidróxido de aluminio Son compuestos formados por un metal y el grupo hidroxilo (OH) - Cuando se disuelven en agua originan disoluciones básicas, de ahí que también se denominen bases. Se recomienda la nomenclatura de STOCK.
- 24. III. Compuestos ternarios 2. Ácidos oxácidos u oxoácidos Son compuestos formados por hidrógeno, no metal y oxígeno. donde X es un no metal o un metal con alto estado de oxidación. •Se obtienen añadiendo agua al óxido correspondiente: óxido + agua oxoácido Ej. N2O5 + H2O H2N2O6 HNO3 Su fórmula general es: HaXbOc
- 25. Compuesto Tradicional H2CO3 ácido carbónico H2SiO3 ácido metasilícico H4SiO4 Ac. ortosilícico Ácidos oxácidos del grupo de los carbonoideos: C (+4), Si (+4) CO2 + H2O H2CO3 SiO2 + H2O H2SiO3 SiO2 +2 H2O H4SiO4 III. Compuestos ternarios 2. Ácidos oxácidos
- 26. Compuesto Tradicional HNO2 ácido nitroso HNO3 ácido nítrico Ácidos oxácidos del grupo de los nitrogenoideos: N (+1, +3, +5) N2O3 + H2O HNO2 N2O5 + H2O HNO3 III. Compuestos ternarios 2. Ácidos oxácidos
- 27. Compuesto Tradicional H2SO3 ácido sulfuroso H2SO4 ácido sulfúrico Ácidos oxácidos del grupo 16 (anfígenos): S, Se, Te (+4, +6) SO2 + H2O H2SO3 SO3 + H2O H2SO4 III. Compuestos ternarios 2. Ácidos oxácidos
- 28. III. Compuestos ternarios 2. Ácidos oxácidos ácido hipocloroso ácido cloroso ácido clórico ácido perclórico Ácidos oxácidos del grupo 17 (halógenos): Cl, Br, I (+1, +3, +5, +7) Cl2O + H2O HClO Cl2O3 + H2O HClO2 Cl2O5 + H2O HClO3 Cl2O7 + H2O HClO4
- 29. Ácidos oxácidos del grupo 15 (nitrogenoideos): P, As, Sb (+3, +5) pueden formar más de un oxoácido con el mismo número de oxidación. óxido + H2O oxoácido META oxido + 2H2O oxoácido Di óxido + 3H2O oxoácido (ORTO) III. Compuestos ternarios 2. Ácidos oxácidos
- 30. P2O5 + H2O HPO3 P2O5 + 2H2O H4P2O7 P2O5 + 3H2O H6P2O8 H3PO4 III. Compuestos ternarios 2. Ácidos oxácidos Ac. Metafosfórico Ác. Difosfórico Ác. (Orto)fosfórico P2O3 + H2O H2P2O4 HPO2 P2O3 + 2H2O H4P2O5 P2O3 + 3H2O H6P2O6 H3PO3 Ac. Metafosforoso Ác. Difosforoso Ác. (Orto)fosforoso
- 31. Ácidos oxácidos del grupo de los 13: B (+3) H3BO3 ácido bórico • Ácidos oxácidos del manganeso: Mn (+4, +6, +7) MnO2 + H2O H2MnO3 MnO3 + H2O H2MnO4 Mn2O7 + H2O HMnO4 ácido manganoso ácido mangánico ácido permangánico III. Compuestos ternarios 2. Ácidos oxácidos
- 32. • Ácidos oxácidos del cromo: Cr (+6) Se obtienen los dos oxoácidos siguientes: CrO3 + H2O H2CrO4 2 H2CrO4 - H2O H2Cr2O7 III. Compuestos ternarios 2. Ácidos oxácidos ácido dicrómico ácido crómico
- 33. Son derivados de un oxoácido, se sustituye el (los) hidrógeno(s) por un metal. oxoácido “quitar” H poner un metal. El metal tendrá de subíndice el nº de hidrógenos del ácido Al resto del ácido se pone de subíndice la valencia del metal HNO3 Ca Ca(NO3)2 NOMENCLATURA Ácido Sal -OSO - ITO -ICO - ATO III. Compuestos ternarios 3. oxosales neutras
- 34. III. Compuestos ternarios 3. Oxosales Ácido Sal Stock HNO3 Ác. nítrico NaNO3 nitrato de sodio H2SO3 Ac. sulfuroso CaSO3 sulfito de calcio H3PO4 Ac. fosfórico Cu3(PO4)2 fosfato de cobre (II) HNO2 Sn(NO2)4 nitrito de estaño (IV) Ácido Sal -oso - ito -ico ato
- 35. Nombre Fórmula Sulfito de cobre (II) CuSO3 Fosfito de bario Ba3(PO3)2 Sulfato de calcio CaSO4 Permanganato de bario Ba(MnO4)2 Peryodato de litio LiIO4 Cromato de plata Ag2CrO4 Clorito de sodio NaClO2 Carbonato de magnesio MgCO3 Yodato de calcio Ca(IO3)2 Perclorato de manganeso(II) Mn(ClO4)2 Nitrato de plata AgNO3 Dicromato de aluminio Al2(Cr2O7)3 3. Oxosales Ejemplos
- 36. V. Ion amonio EJEMPLOS NH4Cl Cloruro de amonio (NH4)2S Sulfuro de amonio (NH4)2SO4 Sulfato de amonio NH4ClO4 Perclorato de amonio Es el catión NH4 +. Funciona con valencia 1
- 37. IV. Compuestos superiores 1. Oxosales ácidas Son sales que aún contienen H en su estructura. Derivan de la sustitución parcial de un ácido poliprótico por metales. H3PO4 - 3 H+ - H+ - 2 H+ HPO4 2- PO4 3- H2PO4 - + 3 Na+ + Na+ + 2 Na+ NaH2PO4 Na2HPO4 Na3PO4 oxosales ácidas
- 38. IV. Compuestos superiores 1. Oxosales ácidas Comp. Stock Na2HPO4 hidrógenofosfato de sodio NaH2PO4 dihidrógenofosfato de sodio KHCO3 hidrógenocarbonato de potasio Cr(HSO3)3 hidrógenosulfito de cromo (III) Son sales que aún contienen H en su estructura. Derivan de la sustitución parcial de un ácido poliprótico por metales. La nomenclatura recomendada es la de STOCK