Semana 2
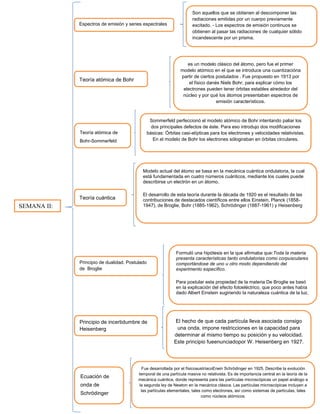
- 1. Son aquellos que se obtienen al descomponer las radiaciones emitidas por un cuerpo previamente Espectros de emisión y series espectrales excitado. - Los espectros de emisión continuos se obtienen al pasar las radiaciones de cualquier sólido incandescente por un prisma. es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantizacióna partir de ciertos postulados . Fue propuesto en 1913 por Teoría atómica de Bohr el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos. Sommerfeld perfeccionó el modelo atómico de Bohr intentando paliar los dos principales defectos de éste. Para eso introdujo dos modificaciones Teoría atómica de básicas: Órbitas casi-elípticas para los electrones y velocidades relativistas. Bohr-Sommerfeld En el modelo de Bohr los electrones sólogiraban en órbitas circulares. Modelo actual del átomo se basa en la mecánica cuántica ondulatoria, la cual está fundamentada en cuatro números cuánticos, mediante los cuales puede describirse un electrón en un átomo. El desarrollo de esta teoría durante la década de 1920 es el resultado de las Teoría cuántica contribuciones de destacados científicos entre ellos Einstein, Planck (1858- SEMANA II: 1947), de Broglie, Bohr (1885-1962), Schrödinger (1887-1961) y Heisenberg Formuló una hipótesis en la que afirmaba que:Toda la materia presenta características tanto ondulatorias como corpusculares Principio de dualidad. Postulado comportándose de uno u otro modo dependiendo del de Broglie experimento específico. Para postular esta propiedad de la materia De Broglie se basó en la explicación del efecto fotoeléctrico, que poco antes había dado Albert Einstein sugiriendo la naturaleza cuántica de la luz. Principio de incertidumbre de El hecho de que cada partícula lleva asociada consigo Heisenberg una onda, impone restricciones en la capacidad para determinar al mismo tiempo su posición y su velocidad. Este principio fueenunciadopor W. Heisenberg en 1927. Fue desarrollada por el físicoaustríacoErwin Schrödinger en 1925. Describe la evolución temporal de una partícula masiva no relativista. Es de importancia central en la teoría de la Ecuación de mecánica cuántica, donde representa para las partículas microscópicas un papel análogo a onda de la segunda ley de Newton en la mecánica clásica. Las partículas microscópicas incluyen a las partículas elementales, tales como electrones, así como sistemas de partículas, tales Schrödinger como núcleos atómicos.
