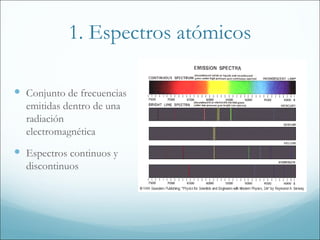
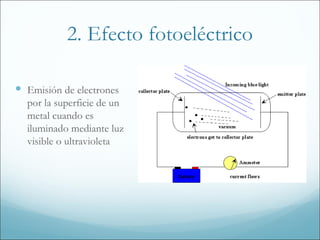
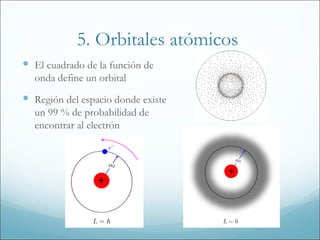
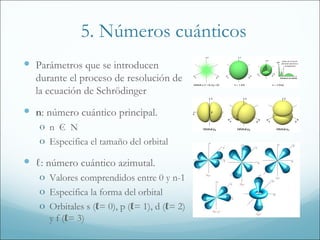
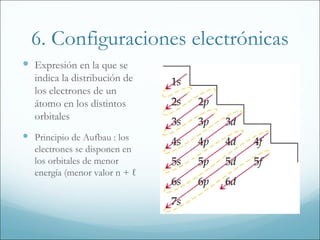
1. El documento resume los principales modelos y conceptos sobre la estructura atómica, desde los primeros modelos clásicos hasta la mecánica cuántica moderna. Incluye los espectros atómicos, la teoría cuántica, el modelo de Bohr, la mecánica cuántica, los orbitales atómicos y las configuraciones electrónicas.
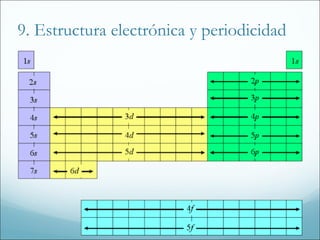
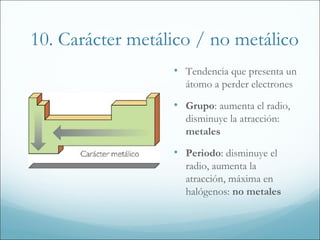
2. También explica la evolución histórica de la tabla periódica, incluyendo las aportaciones de Mendeleiev, y las tendencias periódicas