Energía reticular
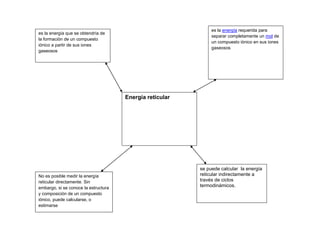
- 1. es la energía requerida para es la energía que se obtendría de separar completamente un mol de la formación de un compuesto un compuesto iónico en sus iones iónico a partir de sus iones gaseosos gaseosos Energía reticular se puede calcular la energía No es posible medir la energía reticular indirectamente a reticular directamente. Sin través de ciclos embargo, si se conoce la estructura termodinámicos. y composición de un compuesto iónico, puede calcularse, o estimarse
- 2. A+B → AB Donde A y B representan cualquier sustancia química. Elementos o compuestos sencillos que se unen para formar un compuesto más complejo Combinación de reacciones químicas Un ejemplo de este tipo de reacción es la síntesis del cloruro de sodio: 2Na(s) + Cl2(g) → 2NaCl(s)
- 3. A este tipo de reacciones se le puede En una reacción de descomposición, considerar como el inverso de las una sola sustancia se descompone o reacciones de combinación. se rompe, produciendo dos o más sustancias distintas Descomposicion de reacciones quimicas El material inicial debe ser un compuesto y los productos pueden ser elementos o compuestos.
- 4. Una reacción de neutralización Cuando en la reacción participan es una reacción entre un ácido y un ácido fuerte y una base fuerte una base. se obtiene sal neutra y agua Neutralizacion. Así pues, se puede decir que la Mientras que si una de las neutralización es la combinación de especies es de naturaleza débil cationes hidrógeno y de aniones hidróxido se obtiene su respectiva especie para formar moléculas de agua. Durante conjugada y agua. este proceso se forma una sal. Las reacciones de neutralización son generalmente exotérmicas,
- 5. Para que exista una reacción de reducción- oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte: toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación El agente reductor es El agente oxidante es aquel elemento el elemento químico químico que que tiende a captar suministra electrones esos electrones, de su estructura química al medio, quedando con un aumentando su estado de oxidación estado de oxidación, inferior al que tenía, es es decir, siendo decir, siendo reducido. oxidado. Oxido-Reduccion Cuando un elemento químico reductor cuando un elemento químico capta cede electrones al medio, se convierte electrones del medio, este se en un elemento oxidado convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado
- 6. La reacción inversa de la En la industria, los reacción redox (que produce energía) es la procesos redox también electrólisis, en la cual se son muy importantes, tanto aporta energía para por su uso productivo disociar elementos de sus moléculas. Aplicaciones. por ejemplo la reducción de minerales para la obtención del aluminio o del hierro
