Formulacionnomenclatura
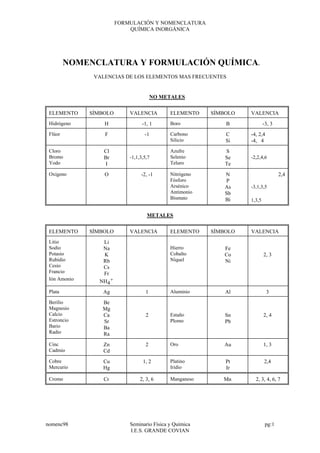
- 1. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:1 I.E.S. GRANDE COVIAN NOMENCLATURA Y FORMULACIÓN QUÍMICA. VALENCIAS DE LOS ELEMENTOS MAS FRECUENTES NO METALES ELEMENTO SÍMBOLO VALENCIA ELEMENTO SÍMBOLO VALENCIA Hidrógeno H -1, 1 Boro B -3, 3 Flúor F -1 Carbono Silicio C Si -4, 2,4 -4, 4 Cloro Bromo Yodo Cl Br I -1,1,3,5,7 Azufre Selenio Teluro S Se Te -2,2,4,6 Oxígeno O -2, -1 Nitrógeno Fósforo Arsénico Antimonio Bismuto N P As Sb Bi 2,4 -3,1,3,5 1,3,5 METALES ELEMENTO SÍMBOLO VALENCIA ELEMENTO SÍMBOLO VALENCIA Litio Sodio Potasio Rubidio Cesio Francio Ión Amonio Li Na K Rb Cs Fr NH4 + Hierro Cobalto Níquel Fe Co Ni 2, 3 Plata Ag 1 Aluminio Al 3 Berilio Magnesio Calcio Estroncio Bario Radio Be Mg Ca Sr Ba Ra 2 Estaño Plomo Sn Pb 2, 4 Cinc Cadmio Zn Cd 2 Oro Au 1, 3 Cobre Mercurio Cu Hg 1, 2 Platino Iridio Pt Ir 2,4 Cromo Cr 2, 3, 6 Manganeso Mn 2, 3, 4, 6, 7
- 2. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:2 I.E.S. GRANDE COVIAN COMPUESTOS BINARIOS Se da este nombre a los compuestos formados por dos clases de átomos: YaXb . FÓRMULA.- La fórmula de estos compuestos repre- senta la relación mas sencilla de sus constitu- yentes para la que se da la neutralidad eléctrica. FORMULACIÓN.- Para formular un compuesto binario se escribe el símbolo del elemento menos electro- negativo (más a la izquierda en el S.P.) y, a continuación, el del otro elemento. Además se escriben los subíndices que representan el nu- mero de átomos de cada uno presentes en la mínima cantidad de materia con las propiedades de la sustancia. Los subíndices coinciden con los valo- res absolutos de las valencias intercambiadas; cuando no son primos entre sí, se simplifican. NOMENCLATURA.- NORMA GENERAL.- Los compuestos binarios se nombran así: -nombre del elemento más electrone- gativo terminado en "-uro" excepto si es el oxí- geno. -"...de..." -nombre del elemento menos electronegativo TOLERANCIA.- Se tolera el uso de las terminaciones "-oso" (menor valencia) e "-ico" (mayor valen- cia) en el elemento menos electronegativo. En ese caso se suprime la preposición "...de...". EJEMPLOS: CaS sulfuro cálcico o (mejor) sulfuro de calcio ZnCl2 cloruro de cinc; KBr bromuro de potasio, etc. CASOS PARTICULARES I.- CON HIDRÓGENO.- Los compuestos binarios del hidrógeno se pueden nombrar de otras formas: A.- Con los halógenos (elementos del grupo del F) o con el S, Se y Te, - "ácido ..." - nombre apocopado del otro elemento termi- nado en "HÍDRICO" EJEMPLO: H2S, sulfuro de hidrógeno ó ácido sulfhídrico. B.- Con C o Si o un elemento del grupo del N. Se pueden nombrar siguiendo la norma general, pero es mejor con sus nombres tradicionales. EJEMPLOS: CH4 hidruro de carbono o, mejor, metano PH3 hidruro de fósforo o, mejor, fosfina NH3 debe llamarse amoníaco. II.- SI PUEDEN FORMAR MÁS DE UN COMPUESTO BINARIO.- Se nombrarán indicando, a continua- ción del nombre del elemento menos electrone- gativo, su valencia en números romanos entre paréntesis (Sistema de Stock) EJEMPLOS: FeCl2 cloruro de hierro(II) o (tolerado) ferroso. FeCl3 cloruro de hierro(III) o (tolerado) fé- rrico. III.- ENTRE DOS NO-METALES.- Cuando los compuestos binarios estén formados por dos no-metales se nombran ex- presando sus subíndices mediante los prefijos griegos, di, tri, tetra, penta, etc.- No se nombra el subíndice 1. EJEMPLOS.: ClF3 trifluoruro de cloro PCl5 pentacloruro de fósforo. Sb2S3 trisulfuro de diantimonio ÓXIDOS Llamaremos óxidos a los compuestos binarios del oxígeno con cualquier otro ele- mento, tanto metálico como no metálico. A.- NOMENCLATURA Distinguiremos entre óxidos metálicos y no metálicos. 1.- ÓXIDOS METÁLICOS Se nombran así: - "óxido de..." - nombre del metal, sin modificación alguna. Si no basta para evitar ambigüedad se sigue con el numero de valencia con que actúa, en números romanos entre paréntesis: Li2O óxido de litio BeO óxido de berilio Na2O óxido de sodio CaO óxido de calcio Al2O3 óxido de aluminio NiO óxido de níquel (II)
- 3. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:3 I.E.S. GRANDE COVIAN Co2O3 óxido de cobalto (III) SnO2 óxido de estaño (IV), etc. 2.- ÓXIDOS NO METÁLICOS Los óxidos de los no metales se nombran así: - "óxido... precedido del prefijo de cantidad correspon- diente, salvo si fuese "mono" en cuyo caso debe omitirse. - preposición "de" - nombre del otro elemento sin modificar y pre- cedido del prefijo de cantidad adecuado, salvo si es "mono" que conviene omitir. Ejemplos: B2O3 trióxido de diboro Cl2O óxido de dicloro, etc. ÚNICA EXCEPCIÓN: H2O, se llamará siempre agua. B.- FORMULACIÓN Los óxidos se formarán escribiendo el símbolo del oxígeno en último lugar, tanto si el elemento acompañante es metálico como si no lo es. Los subíndices son los necesarios para la saturación de todas las valencias de ambos elementos, teniendo presente que la del oxígeno es siempre 2. Tal como se recoge en la relación que se da en el párrafo sobre nomenclatura. C.- TOLERANCIA En el caso de los óxidos metálicos se tolera el uso de las modificaciones -oso e -ico, siempre que se empleen correctamente. CaO óxido cálcico FeO óxido ferroso CuO óxido cúprico Hg2O óxido mercurioso Ni2O3 óxido niquélico HIDRÓXIDOS Se llaman HIDRÓXIDOS a los com- puestos ternarios formados por un metal y uno o más grupos oxhidrilo, OH-. O sea, grupos constituidos por oxígeno e hidrógeno enlazados entre sí de modo que el hidrógeno satura una de las valencias del oxígeno quedando libre la otra. NOMBRE.- Los hidróxidos se nombran siempre de la misma forma: - "hidróxido de ... " - nombre del metal, sin modificación y seguido de su valencia en numero romano entre parén- tesis , cuando es necesario para romper ambigüedades (Stock). FORMULACIÓN.- Se formulan escribiendo el símbolo del metal sin ningún subíndice y, a su derecha el símbolo OH, sin más si la valencia del metal es 1. Si el metal actúa con valencia superior el OH debe ir entre paréntesis seguido de un subíndice igual a la valencia del metal, ahora en caracteres arábigos. EJEMPLOS: LiOH hidróxido de litio Be(OH)2 " berilio Al(OH)3 " aluminio Sn(OH)4 " estaño (IV) ÁCIDOS. 1. ÁCIDOS HIDRÁCIDOS Algunos de los compuestos binarios formados por la unión de un no metal con hi- drógeno tienen propiedades ácidas al disolverse en agua. Estos no metales son los del grupo de los halógenos (F, Cl, Br e I) y de los anfígenos (S, Se y Te). Así, la disolución de cloruro de hi- drógeno (gas) en agua presenta un marcado ca- rácter ácido. Para nombrar estos ácidos se utiliza el sufijo hídrico. Así, por ejemplo: HCl ácido clorhídrico 2. ÁCIDOS OXOÁCIDOS. Son compuestos formados por oxí- geno, hidrógeno y un elemento no metálico que manifiestan carácter ácido y que responden a la siguiente fórmula general: HaXbOc donde X, es casi siempre un no metal, pero, a veces, puede ser un metal de transición. Este curso vamos a ver solamente la formulación funcional de los ácidos más co- rrientes (admitida por la IUPAC) dejando para más adelante la formulación de otros ácidos y la formulación sistemática.
- 4. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:4 I.E.S. GRANDE COVIAN Los ácidos oxoácidos se nombran mediante la palabra genérica ÁCIDO y una es- pecífica que contiene la raíz del elemento cen- tral, normalmente no metálico, y prefijos y sufijos que indican la valencia de dicho elemento central de acuerdo con la siguiente tabla: que tiene la excepción del grupo del carbono y silicio, cuyos ácidos se nombran con la termi- nación ico a pesar de tener valencia + 4. Cuando solo existe una valencia posible, sea cual sea, la terminación es ico. Se formulan colocando en primer lu- gar el hidrógeno en número de 1 si la valencia del elemento central es impar y de 2 si es par. A continuación el elemento no metálico (en los ácidos sencillos un solo átomo) y finalmente el oxígeno. Para saber el número de oxígenos que hay en la molécula de cada ácido hay que tener en cuenta que en estos compuestos siempre el hidrógeno tiene valencia +1, el oxígeno -2 y la molécula de ácido es neutra (valencia 0). Por ejemplo: Ácido nítrico HN03 según la tabla, el nitrógeno tiene valencia +5 ya que acaba en ico, lo que implica 1 hidrógeno y llamando c al nº de oxígenos: 1 + 5 + c(-2) = 0 6 - 2c = 0 6 = 2c c = 3 Otra forma de actuar consiste en consi- derar los ácidos oxoácidos como derivados de los óxidos no metálicos y agua (en unos casos la reacción se produce efectivamente y en otros no). En el ejemplo anterior, como la terminación ico indica valencia +5,: N205 + H20 -------> H2N206 -------> 2 HN03 Los óxidos de fósforo, arsénico y anti- monio, reaccionan, sin embargo, con tres molé- culas de agua para formar los ácidos oxoácidos más corrientes de estos elementos que se nom- bran con el prefijo orto, que se puede omitir aunque conviene no hacerlo. Así: P205 + 3 H20 = 2 H3P04 ácido (orto)fosfórico En el caso del silicio, el ácido (orto)silícico se formaría al añadir dos moléculas de agua al óxido correspondiente: Si02 + 2 H20 = H4Si04 Sin embargo, el ácido carbónico es H2C03 Como ejemplos de ácidos importantes (dan lugar a sales muy utilizadas en química) en los que el elemento central es un elemento me- tálico, con valencias elevadas, tenemos: H2Cr04 ácido crómico H2Cr207 ácido dicrómico H2Mn04 ácido mangánico HMn04 ácido permangánico que siguen las reglas de formulación expresadas en el cuadro anterior. SALES NEUTRAS Para su formulación, se sustituyen todos los hidrógenos de los ácidos por cationes metálicoscomo , por ejemplo: Del HCl AgCl Del H2S CaS Del H2SO4 MgSO4 Del,H3PO4 AlPO4 1. SALES BINARIAS NEUTRAS Formadas por un mettal y un no metal. Se nombran como cualquier compuesto binario y por tanto terminados en URO. Los elementos no metálicos tiene los siguientes estados de oxidación: F, Cl, Br, I, -1 S, Se, Te : -2 EJEMPLOS: Valencias Prefi. Sufijo Ejemplo + 1 hipo oso HClO ácido hipocloroso + 4 + 3 oso H2SO3 ácido sulfuroso HNO2 ácido nitroso + 6 + 5 ico H2SO4 ácido sulfúrico HBrO3 ácido brómico + 7 per ico HIO4 ácido peryódico
- 5. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:5 I.E.S. GRANDE COVIAN NaF Fluoruro de sodio NaCl Cloruro de sodio KBr Bromuro de potasio MgI2 Yoduro de magnesio Na2S Sulfuro de sodio CaSe Seleniuro de calcio Fe2Te3 Telururo de sodio 2. SALES TERNARIAS u OXOSALES Si el ácido termino en OSO, la sal termina en ITO. Si el ácido termina en ICO, la sal termina en ATO. De ácido hipocloroso (HClO) deriva hipoclorito de sodio (Na ClO) De ácido sulfúrico (H2SO4) deriva sulfato de calcio (CaSO4) EJEMPLOS: MgSO3 Sulfito de magnesio Zn(IO4)2 peryodato de cinc Ca3(PO4)2 (orto)fosfato de calcio
- 6. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:6 I.E.S. GRANDE COVIAN 3er. CURSO ÓXIDOS Las combinaciones del oxígeno y flúor deben tener una consideración especial: FORMULACIÓN.- El flúor es más electronegativo que el oxígeno por lo que debe formularse en segundo lugar, OF2. NOMBRE.- Deben nombrarse como fluoruros de oxígeno. OF2 , difluoruro de oxígeno O2 F2 , difluoruro de dioxígeno ADEMÁS.- En todas las combinaciones binarias, tanto con oxígeno como sin él, se usaron los prefijos "sesqui" y "hemi" del elemento más electronegativo para designar las relaciones atómicas 2/3 y 1/2, cuando el otro elemento sea un no-metal. EJEMPLOS.- N2O hemióxido de nitrógeno; mejor que óxido de dinitrógeno Bi2O3 sesquióxido de bismuto; mejor que óxido de bismuto(III). Otros óxidos de nitrógeno se denominan con su nombre tradicional NO óxido nítrico N2O óxido nitroso PERÓXIDOS Se conocen con este nombre a las combinaciones de un metal (alcalino o alclino- térreo ) y el grupo peroxo : O2 2- ( O-O)2- NOMBRE.- Se nombran así: - " Peróxido de ....... " - Nombre del metal, sin modificación. EJEMPLOS.- Na2O2 peróxido de sodio CaO2 peróxido de calcio ÁCIDOS. 1. Ácidos hidrácidos. Para nombrar estos ácidos se utiliza el sufijo hídrico. Así, por ejemplo: HCl cloruro de hidrógeno HCl(aq) ácido clorhídrico El símbolo (aq) se utiliza para distinguir el ácido clorhídrico del cloruro de hidrógeno, que es un gas, mientras que el ácido es la disolución en agua de dicho gas. H2S(aq) ácido sulfhídrico También acaba en hídrico, el ácido que contiene el grupo CN- y del que derivan los cianuros: HCN ácido cianhídrico 2. Ácidos oxoácidos polihidratados. Son oxoácidos en cuya molécula existe un número de átomos de hidrógeno y oxígeno igual o mayor que el que corresponde al ácido simple. Para su formulación pueden conside- rarse derivados de la adición de una, dos o tres moléculas de agua a la molécula del oxido ácido correspondiente. Aplicando la idea anterior, la fórmula general, la podemos desarrollar así: EyOx + nH2O = H2nEyOx+n fórmula general que se simplifica si los coefi- cientes resultantes son pares. Se nombran con la palabra ÁCIDO seguido de la raíz del elemento central al que le precede un PREFIJO -que indica el grado de hi- dratación- y el SUFIJO correspondiente a la va- lencia del elemento central. Los prefijos que se usan son: Para los elementos del grupo V-A (P, As, Sb) META cuando n=1 PIRO cuando n=2 ORTO cuando n=3 (este prefijo puede, aunque no conviene, omitirse) Para el boro (III-A) META cuando n=1 ORTO cuando n=3 (idem) Para el Silicio (IV-A)
- 7. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:7 I.E.S. GRANDE COVIAN META cuando n=1 ORTO cuando n=2 (idem) Así: P203 + H20 = 2 HP02 ácido metafosforoso As205 + 2 H20 = H4As207 ácido piroarsénico Sb203 + 3 H20 = 2 H3Sb03 ácido (orto)antimonioso B203 + H20 = HB02 ácido metabórico Si02 + H20 = H2Si03 ácido metasilícico También se obtienen los ácidos PIRO (denominados igualmente con el prefijo DI) a los ácidos que resultan de la eliminación de una molécula de agua a partir de dos del ácido orto correspondiente. Por ejemplo: 2 H2S03 - H20 = H2S205 ácido pirosulfuroso o disulfuroso SALES ÁCIDAS Derivan de la sustitución parcial de los átomos de hidrógeno en los ácidos por elemen- tos o grupos con carácter metálico. Esta sustitu- ción puede darse tanto en los ácidos oxoácidos como en los hidrácidos. Se nombran como las sales neutras an- teponiendo un numeral que indica los átomos de hidrógeno no sustituidos y el prefijo hidró- geno a la primera palabra del nombre de la sal. El resto se nombra igual que las neutras. El nu- meral mono suele omitirse. Los ácidos con un solo hidrógeno no formarán sales ácidas. Aunque normalmente to- dos los hidrógenos son substituibles por metales hay excepciones. Por ejemplo, en los ácidos del fósforo: H3PO2 tiene solo un átomo de hidró- geno substituible H3PO3 tiene solo dos átomos de hidró- geno sustituibles. EJEMPLOS.- KHS hidrógenosulfuro de potasio. NaHCO3 hidrógeno carbonato de sodio. LiH2PO4 Dihidrógeno fosfato de litio. KHSO4 Hidrógeno sulfato de potasio. SALES DOBLES De las dos posibilidades que existen, solo vamos a contemplar las sales que contienen en su molécula dos o más elementos o grupos metálicos. Se nombran conservando el mismo nombre de la sal sencilla neutra correspondiente (oxisal o haloidea) y añadiendo el nombre de los dos elementos o grupos metálicos, por orden alfabético, con la notación de Stock para indicar la valencia. En medio, y entre paréntesis, se coloca la expresión doble, triple,... Por ejemplo: CaKCl3 Cloruro (doble) de calcio y potasio MgHg (CO3)2 Carbonato (doble) de magnesio y mercurio (II).
- 8. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:8 I.E.S. GRANDE COVIAN COU TIOÁCIDOS Son oxoácidos en los que se ha susti- tuido uno o más oxígenos por azufre. Se nombran como el oxoácido del que proceden introduciendo el prefijo TIO. Si la sustitución puede afectar a más de un oxígeno el numero de átomos de azufre introducidos se indican mediante prefijos numerales griegos. Por ejemplo: H2S2O3 ácido tiosulfúrico H3PO3S ácido (mono)tiofosfórico H3PO2S2 ácido ditiofosfórico H3AsS4 ácido tetratioarsénico FORMULACIÓN SISTEMÁTICA DE OXOÁCIDOS. En los oxoácidos de fórmula general HaXbOc , se puede distinguir un átomo central, X, al que estén directamente unidos los átomos de oxígeno formando un grupo, (XbOc)a- , poliatómico y electronegativo (NO3 - en el HNO3 ). La parte electropositiva la constituye el hidrógeno. Según esto los oxoácidos pueden de- signarse como compuestos binarios citando la parte electronegativa con el prefijo OXO y, a continuación, la raíz del nombre del átomo cen- tral, X, acabada en ATO. La parte electropositiva será la palabra HIDRÓGENO. Las proporciones de los constituyentes se indican mediante los prefijos numerales co- rrespondientes, así como el índice de oxidación de X expresado en números romanos entre pa- réntesis. En general pueden omitirse cuantos prefijos sean innecesarios. numeral OXO numeral RAÍZ(X)ATO índ. oxidac. (X)... de HIDRÓGENO 1. Dado el nombre hallar la fórmula. Formular el ácido tetraoxomanganato (VII) de hidrógeno: Como el ácido es una molécula neutra, su índice de oxidación será cero. Sabemos que el índice de oxidación del átomo central (en este caso manganeso) es +7; el del oxígeno siempre es -2 (tetraoxo indica que hay 4) y el del hidrógeno siempre +1; por lo que llamando a al número de átomos de hidrógeno, tendremos: a(+1) + 7 + 4 (-2) = 0 ; a + 7 - 8 = 0 ; lo que implica que a = 1 con lo que la fórmula buscada es: HMnO4 . 2. Dada la fórmula hallar el nombre. Vamos a encontrar el nombre del ácido H4 P207 . Se plantea la misma ecuación. Ahora lo que desconocemos es el índice de oxidación del átomo central, en este caso el de fósforo. Lla- mando x a dicho índice: 4(+1) + 2(+x) + 7(-2) = 0 ; 4 + 2x - 14 = 0 ; lo que implica: x = 5 por tanto, el nombre es heptaoxodifosfato (V) de hidrógeno. OTROS ÁCIDOS. HCNO ácido ciánico. SALES 1.- SALES DOBLES, TRIPLES, ..ANIONES Los aniones se citarán en orden alfabético con los prefijos bis, tris, tetrakis, pentakis, ...... ya que los prefijos di tri, tetra, penta,.... se han utilizado ya para designar aniones condensados. EJEMPLOS: Na6ClF(SO4)2 cloruro fluoruro bis (sulfato de sodio) Ca5F(PO4)3 fluoruro tris(fosfato) de calcio. SISTEMÁTICA FUNCIONAL H2SO4 tetraoxosulfato (VI) de hidrógeno ác. sulfúrico H3PO3 trioxofosfato (III) de hidrógeno ác. fosfórico HClO oxoclorato (I) de hidrógeno ác. hipocloroso H4As2O5 pentaoxodiarseniato (III) de hidrógeno ác. piroarsenioso H2Cr207 heptaoxodicromato (VI) de hidrógeno ác. dicrómico H3P02S2 dioxoditiofosfato (V) de hidrógeno ác. ditiofosfórico
- 9. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:9 I.E.S. GRANDE COVIAN 2.- SALES BÁSICAS Se nombran anteponiendo la palabra hidroxi a los aniones anteriores. EJEMPLOS: MgClOH Hidroxicloruro de magnesio Cu2Cl(OH)3 Trihidroxi cloruro de cobre(II) 3.- FORMULACIÓN SISTEMÁTICA En la nomenclatura sistemática la IUPAC facilita la escritura de las sales con tal que se sepa calcular el estado de oxidación del elemento no metálico. Todas las sales terminan en ATO y si el anión entra 2, 3, 4, ... veces se emplean los prefijos: bis, tris, tetrakis, pentakis,.... respectivamente. En la práctica estos prefijos pueden omitirse. EJEMPLOS: Al(BrO3)3 (tris)trioxobromato (V) de aluminio Pt(CO3)2 (bis)trioxocarbonato (IV) de platino(IV) Sn(MnO4)4 (tetrakis)tetraoxomanganato(VII) de estaño (IV)
- 10. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:10 I.E.S. GRANDE COVIAN Ejemplos de Fórmulas y Nomenclatura BaO2 peróxido de bario K2CrO4 tetraoxocromato (VI) de potasio As2O3 trióxido de diarsénico NaMnO4 permanganato de sodio Zn(NO3)2 trioxonitrato (V) de cinc HPO3 ácido metafosfórico LiClO4 perclorato de litio BaO óxido de bario Al2(SO4)3 tetraoxosulfato (VI) de alumnio RaO óxido de radio NH OH4 hidróxido de amonio BaTeO3 trioxotelurato (IV) de bario Na2Te telururo de sodio PH3 fosfina Pt(OH)4 hidróxido de platino (IV) MgO óxido de magnesio NiCl2 cloruro de niquel (II) Cd(OH)2 hidróxido de cadmio MnO2 óxido de manganeso (IV) CaO óxido de calcio Cs2O óxido de cesio H2SeO4 ácido tetraoxoselénico (VI) SO3 triòxido de azufre H2SO3 trioxosulfato (IV) de hidrógeno Na2S sulfuro de sodio CoO óxido de cobalto (II) Fe(NO2)2 nitrito de hierro (II) Ca(HCO3)2 hidrogenocarbonato de calcio I2O7 heptaóxido de diyodo TiCl3 cloruro de titanio (III) HBrO3 ácido brómico H2SiO3 ácido metasilícico FeO óxido de hierro (II) Br2O7 heptaóxido de dibromo HClO3 trioxoclorato (V) de hidrógeno HClO ácido hipocloroso HgO óxido de mercurio (II) HF(aq) ácido fluorhídrico FeSO4 tetraoxosulfato (VI) de hierro (II) HIO4 ácido tetraoxoyódico (VII) NaF fluoruro de sodio Cl2O3 trióxido de dicloro MgSeO3 trioxoseleniato (IV) de magnesio HNO2 ácido dioxonítrico (III) H2SO4 tetraoxosulfato (VI) de hidrógeno Na2O óxido de sodio PbS seleniuro de plomo (II) HClO2 ácido cloroso I2O5 pentaóxido de diyodo Cu2SO4 tetraoxosulfato (VI) de cobre (I) Al2(HPO4)3 hidrógenofosfato de aluminio Hg2O óxido de mercurio (I) (NH4)Cl cloruro de amonio BH3 borano H2CO3 ácido carbónico Be(OH)2 hidróxido de berilio N2O5 pentaóxido de dinitrógeno ZnO óxido de cinc CaSO3 sulfito de calcio Pb(ClO2)2 clorito de plomo (II) KIO4 tetraoxoyodato (VII) de potasio Na2CO3 trioxocarbonato (IV) de sodio HF fluoruro de hidrógeno Rb2O óxido de rubidio Sr(OH)2 hidróxido de estroncio Na2HPO4 hidrógenofosfato de sodio Li2O2 peróxido de litio (NH4)2S sulfuro de amonio Ca(OH)2 hidróxido de calcio H2TeO4 tetraoxotelúrato (VI) de hidrógeno HIO3 trioxoyodato (V) de hidrógeno Al4(SiO4)3 ortosilicato de aluminio Co(NO3)3 nitrato de cobalto (III) AuOH hidróxido de oro (I) Fe2O3 óxido de hierro (III) Ni(ClO2)2 dioxoclorato (III) de niquel(II) SnCl2 cloruro de estaño (II) Cl2O monóxido de dicloro Fe(OH)2 hidróxido de hierro (II) PbI2 yoduro de plomo (II) Bi(OH)3 hidròxido de bismuto SrH2 hidruro de estroncio HBr bromuro de hidrógeno Cd(ClO)2 oxoclorato (I) de cadmio SeO3 trióxido de selenio HNO2 ácido nitroso K 2CrO4 cromato de potasio Br2O3 trióxido de dibromo Au2O óxido de oro (I) Cu2O óxido de cobre (I) Na2SO4 sulfato de sodio Al2(SO4)3 sulfato de alumnio SbH3 estibina Na3AsO4 ortoarseniato de sodio FeCl2 cloruro de hierro (II) Ag2O óxido de plata NaOH hidróxido de sodio NH4ClO4 tetraoxoclorato (VII) de amonio NaI yoduro de sodio CO monóxido de carbono Ag2CO3 trioxocarbonato (IV) de plata H2Te(aq) ácido telurhidríco Ni(OH)3 hidróxido de niquel (III) H2SO4 ácido sulfúrico
- 11. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:11 I.E.S. GRANDE COVIAN SrO2 peróxido de estroncio H2SeO4 ácido selénico AsH3 arsina H2CO3 trioxocarbonato (IV) de hidrógeno SnH4 hidruro de estaño (IV) H3AsO3 ácido ortoarsenioso LiMnO4 permanganato de litio H2Cr2O7 ácido dicrómico PbO óxido de plomo (II) Mn(OH)2 hidróxido de manganeso (II) Zn(OH)2 hidróxido de cinc Mg(OH)2 hidróxido de magnesio H2O2 peróxido de hidrógeno BaCO3 carbonato de bario Cu(BrO3)2 bromato de cobre (II) CdO óxido de cadmio H2S2O7 ácido disulfúrico H3PO4 acido ortofosfórico // ácido fosfórico MnSO4 tetraoxosulfato (VI) de manganeso (II) H2O2 agua oxigenada CrCl3 cloruro de cromo (III) H2CrO4 ácido crómico Ni(OH)2 hidróxido de níquel (II) Pb(OH)4 hidróxido de plomo (IV) HCl cloruro de hidrógeno MgSO4 sulfato de magnesio (NH4)2SO3 sulfito de amonio LiBrO2 bromito de litio K2Cr2O7 dicromato de potasio HBrO4 ácido perbrómico (NH4)H2PO4 dihidrógenofosfato de amonio H3BO3 ácido ortobórico // ácido bórico H2SO4 tetraoxosulfato (VI) de hidrógeno Au2O3 óxido de oro (III) I2O5 pentaóxido de diyodo CH4 metano Au(OH)3 hidróxido de oro (III) AgCl cloruro de plata AuCl3 cloruro de oro (III) AgOH hidróxido de plata H2Se(aq) ácido selenhídrico PbO2 óxido de plomo (IV) AgClO4 perclorato de plata NaHSO4 hidrógenosulfato de sodio HCl(aq) ácido clorhídrico Zn(NO3)2 nitrato de cinc Co2O3 óxido de cobalto (III) Fe2(SO4)3 tetraoxosulfato (VI) de hierro (III) Li2O óxido de litio NaHCO3 hidrógenocarbonato de sodio SrO óxido de estroncio CoTe telururo de cobalto (II) H4P2O7 ácido heptaoxodifosfórico (V) HNO3 trioxonitrato (V) de hidrógeno H3AsO3 ácido arsenioso H2Te telururo de hidrógeno KNO2 nitrito de potasio KCl cloruro de potasio FeCl3 cloruro de hierro (III) HNO3 ácido nítrico I2O monóxido de diyodo Fe(NO2)3 dioxonitrato (III) de hierro(III) KH hidruro de potasio Ba(OH)2 hidróxido de bario H2O agua LiNO2 nitrito de litio CsH hidruro de cesio Sn(OH)2 hidróxido de estaño (II) CaCl2 cloruro de calcio KHSO4 hidrógenosulfato de potasio Cd(ClO)2 hipoclorito de cadmio Cl2O7 heptaóxido de dicloro Na2SO4 tetraoxosulfato (VI) de sodio Ag2CO3 carbonato de plata K2O óxido de potasio Ti2O3 óxido de titanio (III) BiCl3 cloruro de bismuto (III) NH4ClO4 perclorato de amonio H3PO3 ácido ortofosforoso // ácido fosforoso CoBr2 bromuro de cobalto (II) CaF2 fluoruro de calcio CdI2 yoduro de cadmio HClO2 ácido dioxoclórico (III) AgBr bromuro de plata HBrO2 ácido bromoso Hg(CN)2 cianuro de mercurio (II) SrF2 fluoruro de estroncio CaI2 yoduro de calcio HIO3 ácido yódico HI yoduro de hidrógeno Pt(OH)2 hidróxido de platino (II) HClO4 ácido perclórico CO2 dióxido de carbono H4P2O7 ácido difosfórico // ácido pirofosfórico NaHS hidrógenosulfuro de sodio Sb2O3 óxido de antimonio (III) Ag2SeO4 tetraoxo seleniato (VI) de plata CaH2 hidruro de calcio Cu2SO4 sulfato de cobre (I) H2SeO3 ácido selenioso LiBrO2 dioxobromato (III) de litio Na2CrO4 cromato de sodio KBr bromuro de potasio Au(NO2)3 nitrito de oro (III) Ag2SeO4 seleniato de plata HCN(aq) ácido cianhídrico (NH4)2CO3 carbonato de amonio AuCl3 cloruro de oro (III) H2TeO3 ácido teluroso SO3 trióxido de azufre
- 12. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:12 I.E.S. GRANDE COVIAN Al2O3 óxido de alumnio H2S(aq) ácido sulfhídrico Na3PO4 fosfato de sodio HIO4 ácido peryódico NaH hidruro de sodio Fe(OH)3 hidróxido de hierro (III) SiO2 dióxido de silicio HBr(aq) ácido bromhídrico NiBr2 bromuro de níquel (II) SrS sulfuro de estroncio P2O5 pentaóxido de difósforo H2S2O5 ácido disulfuroso NiO óxido de niquel (II) Cl2O5 pentaóxido de dicloro Pb(ClO2)2 dioxoclorato (III) de plomo (II) (NH4)2Se selenito de amonio AlH3 hidruro de aluminio HCN cianuro de hidrógeno K2HPO4 hidrógenofosfato de potasio BaTeO3 telurito de bario FeI3 yoduro de hierro (III) SnO óxido de estaño (II) HBrO ácido hipobromoso Cu(BrO4)2 tetraoxobromato (VII) de cobre(II) H2CrO4 ácido tetraoxocrómico(VI) Co(OH)3 hidróxido de cobalto (III) MgCr2O7 dicromato de magnesio Cs2S sulfuro de cesio AgI yoduro de plata MgSO3 trioxosulfato (IV) de magnesio BeH2 hidruro de berilio MnCl2 cloruro de manganeso (II) HMnO4 ácido permangánico H2SiO3 ácido metasilícico H2Se seleniuro de hidrógeno Zn(OH)2 hidróxido de cinc CrO óxido de cromo (II) H2TeO4 ácido telúrico Hg(OH)2 hidróxido de mercurio (II) MgH2 hidruro de magnesio KOH hidróxido de potasio HI(aq) ácido yodhídrico H2SO3 ácido sulfuroso Bi2O3 óxido de bismuto (III) SeO2 dióxido de selenio RbOH hidróxido de rubidio CuSO4 tetraoxosulfato (VI) de cobre (II) Cr(OH)3 hidròxido de cromo (III) Na2O2 peróxido de sodio Al(OH)3 hidróxido de aluminio MnO óxido de manganeso (II) SO2 dióxido de azufre PbH4 hidruro de plomo (IV) BH3 hidruro de boro BeO óxido de berilio SnO2 óxido de estaño (IV) PtO óxido de platino (II) HClO3 àcido clórico Ni2O3 óxido de niquel (III) H2S sulfuro de hidrógeno CuO óxido de cobre (II) Pb(OH)2 hidróxido de plomo (II) Cu(OH)2 hidróxido de cobre (II) Cu(BrO3)2 trioxobromato (V) de cobre(II) BaSO4 sulfato de bario HIO ácido hipoyodoso NH3 amoniaco TiO2 óxido de titanio (IV) (NH4)I yoduro de amonio Fe2S3 sulfuro de hierro (III) SnO2 óxido de estaño (IV) Cr2O3 óxido de cromo (III) BaH2 hidruro de bario HClO2 dioxoclorato (III) de hidrógeno Na2Cr2O7 dicromato de sodio CuSO4 sulfato de cobre (II) KMnO4 permanganato de potasio H4SiO4 acido ortosilícico // ácido silícico LiH hidruro de litio PdO óxido de paladio (II) Ba(HCO3)2 hidrógenocarbonato de bario NH4HSO4 hidrógenosulfato de amonio KI yoduro de potasio Co(NO3)3 trioxonitrato(V) de cobalto(III) HNO2 dioxonitrato (III) de hidrógeno NH4Br bromuro de amonio CaSO3 trioxo sulfato (IV) de calcio Sr(NO2)2 nitrito de estroncio H3AsO4 ácido ortoarsénico // ácido arsénico (NH4)2Cr2O7 dicromato de amonio CsOH hidróxido de cesio SiH4 silano (NH4)2CrO4 cromato de amonio Na2CO3 carbonato de sodio Ni(ClO2)2 clorito de níquel(II) TeO2 dióxido de teluro H3BO3 ácido bórico // ácido ortobórico H3AsO4 ácido arsénico // ácido ortoarsénico HBO2 ácido metabórico Sr(NO2)2 dioxonitrato (III) de estroncio Fr2O óxido de francio KIO4 peryodato de potasio N2O3 trióxido de dinitrógeno Co(ClO4)3 tetraoxoclorato (VII) de cobalto(III)
- 13. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:13 I.E.S. GRANDE COVIAN Ordenadas por funciones. H2S(aq) ácido sulfhídrico H2S sulfuro de hidrógeno H2Se seleniuro de hidrógeno H2Se(aq) ácido selenhídrico H2Te telururo de hidrógeno H2Te(aq) ácido telurhidríco HBr bromuro de hidrógeno HBr(aq) ácido bromhídrico HCl cloruro de hidrógeno HCl(aq) ácido clorhídrico HCN(aq) ácido cianhídrico HCN cianuro de hidrógeno HF fluoruro de hidrógeno HF(aq) ácido fluorhídrico HI ioduro de hidrógeno HI(aq) ácido iodídrico AgOH hidróxido de plata Al(OH)3 hidróxido de aluminio Au(OH)3 hidróxido de oro (III) AuOH hidróxido de oro (I) Ba(OH)2 hidróxido de bario Be(OH)2 hidróxido de berilio Bi(OH)3 hidròxido de bismuto Ca(OH)2 hidróxido de calcio Cd(OH)2 hidróxido de cadmio Co(OH)3 hidróxido de cobalto (III) Cr(OH)3 hidròxido de cromo (III) CsOH hidróxido de cesio Cu(OH)2 hidróxido de cobre (II) Fe(OH)2 hidróxido de hierro (II) Fe(OH)3 hidróxido de hierro (III) Hg(OH)2 hidróxido de mercurio (II) KOH hidróxido de potasio Mg(OH)2 hidróxido de magnesio Mn(OH)2 hidróxido de manganeso (II) NaOH hidróxido de sodio NH4OH hidróxido de amonio Ni(OH)2 hidróxido de níquel (II) Ni(OH)3 hidróxido de níquel (III) Pb(OH)2 hidróxido de plomo (II) Pb(OH)4 hidróxido de plomo (IV) Pt(OH)2 hidróxido de platino (II) Pt(OH)4 hidróxido de platino (IV) RbOH hidróxido de rubidio Sn(OH)2 hidróxido de estaño (II) Sr(OH)2 hidróxido de estroncio Zn(OH)2 hidróxido de cinc AlH3 hidruro de aluminio BaH2 hidruro de bario BeH2 hidruro de berilio CaH2 hidruro de calcio CsH hidruro de cesio KH hidruro de potasio LiH hidruro de litio MgH2 hidruro de magnesio NaH hidruro de sodio PbH4 hidruro de plomo (IV) SnH4 hidruro de estaño (IV) SrH2 hidruro de estroncio AsH3 arsina BH3 borano BH3 hidruro de boro CH4 metano H2O agua NH3 amoniaco PH3 fosfina SbH3 estibina SiH4 silano Ag2O óxido de plata Al2O3 óxido de aluminio Au2O óxido de oro (I) Au2O3 óxido de oro (III) BaO óxido de bario BeO óxido de berilio Bi2O3 óxido de bismuto (III) CaO óxido de calcio CdO óxido de cadmio Co2O3 óxido de cobalto (III) CoO óxido de cobalto (II) Cr2O3 óxido de cromo (III) CrO óxido de cromo (II) Cs2O óxido de cesio Cu2O óxido de cobre (I) CuO óxido de cobre (II) Fe2O3 óxido de hierro (III) FeO óxido d hierro (II) Fr2O óxido de francio Hg2O óxido de mercurio (I) HgO óxido de mercurio (II) K2O óxido de potasio Li2O óxido de litio MgO óxido de magnesio MnO óxido de manganeso (II) MnO2 óxido de manganeso (IV) Na2O óxido de sodio Ni2O3 óxido de níquel (III) NiO óxido de níquel (II) PbO óxido de plomo (II) PbO2 óxido de plomo (IV) PdO óxido de paladio (II) PtO óxido de platino (II) RaO óxido de radio Rb2O óxido de rubidio Sb2O3 óxido de antimonio (III) SnO óxido de estaño (II) SnO2 óxido de estaño (IV) SnO2 óxido de estaño (IV) SrO óxido de estroncio Ti2O3 óxido de titanio (III)
- 14. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:14 I.E.S. GRANDE COVIAN TiO2 óxido de titanio (IV) ZnO óxido de cinc As2O3 trióxido de diarsénico Br2O3 trióxido de dibromo Br2O7 heptaóxido de dibromo Cl2O monóxido de dicloro Cl2O3 trióxido de dicloro Cl2O5 pentaóxido de dicloro Cl2O7 heptaóxido de dicloro CO monóxido de carbono CO2 dióxido de carbono I2O monóxido de diyodo I2O5 pentaóxido de diyodo I2O5 pentaóxido de diyodo I2O7 heptaóxido de diyodo N2O3 trióxido de dinitrógeno N2O5 pentaóxido de dinitrógeno P2O5 pentaóxido de difósforo SeO2 dióxido de selenio SeO3 trióxido de selenio SiO2 dióxido de silicio SO2 dióxido de azufre SO3 triòxido de azufre TeO2 dióxido de teluro H2CO3 ácido carbónico H2CO3 trioxocarbonato (IV) de hidrógeno H2Cr2O7 ácido dicrómico H2CrO4 ácido crómico H2CrO4 ácido tetraoxocrómico(VI) H2S2O5 ácido disulfuroso H2S2O7 ácido disulfúrico H2SeO3 ácido selenioso H2SeO4 ácido selénico H2SeO4 ácido tetraoxoselénico (VI) H2SiO3 ácido metasilícico H2SiO3 ácido trioxosilicato (IV) de hidrógeno H2SO3 ácido sulfuroso H2SO3 trioxosulfato (IV) de hidrógeno H2SO4 ácido sulfúrico H2SO4 tetraoxosulfato (VI) de hidrógeno H2TeO3 ácido teluroso H2TeO4 ácido telúrico H2TeO4 tetraoxotelurato (VI) de hidrógeno H3AsO3 ácido arsenioso H3AsO3 ácido ortoarsenioso H3AsO4 ácido arsénico // ácido ortoarsénico H3BO3 ácido bórico // ácido ortobórico H3PO3 ácido ortofosforoso // ácido fosforoso H3PO4 acido ortofosfórico // ácido fosfórico H4P2O7 ácido difosfórico // ácido pirofosfórico H4P2O7 ácido heptaoxodifosfórico (V) H4SiO4 acido ortosilícico // ácido silícico HBO2 ácido metabórico HBrO ácido hipobromoso HBrO2 ácido bromoso HBrO3 ácido brómico HBrO4 ácido perbrómico HClO ácido hipocloroso HClO2 ácido cloroso HClO2 ácido dioxoclórico (III) HClO2 dioxoxcorato (III) de hidrógeno HClO3 àcido clórico HClO3 trioxoclorato (V) de hidrógeno HClO4 ácido perclórico HIO ácido hipoyodoso HIO3 ácido yódico HIO3 trioxoyodato (V) de hidrógeno HIO4 ácido peryódico HIO4 ácido tetraoxoiódico HMnO4 ácido permangánico HNO2 ácido dioxonítrico (III) HNO2 ácido nitroso HNO2 dioxonitrato (III) de hidrógeno HNO3 ácido nítrico HNO3 trioxonitrato (V) de hidrógeno HPO3 ácido metafosfórico (NH4)2CO3 carbonato de amonio (NH4)2Cr2O7 dicromato de amonio (NH4)2CrO4 cromato de amonio (NH4)2SO3 sulfito de amonio Ag2CO3 carbonato de plata Ag2CO3 trioxocarbonato (IV) de plata Ag2SeO4 seleniato de plata Ag2SeO4 tetraoxo seleniato (VI) de plata AgClO4 perclorato de plata Al2(SO4)3 sulfato de aluminio Al2(SO4)3 tetraoxosulfato (VI) de aluminio Al4(SiO4)3 ortosilicato de aluminio Au(NO2)3 nitrito de oro (III) BaCO3 carbonato de bario BaSO4 sulfato de bario BaTeO3 telurito de bario BaTeO3 trioxotelurato (IV) de bario CaSO3 sulfito de calcio CaSO3 trioxo sulfato (IV) de calcio Cd(ClO)2 hipoclorito de cadmio Cd(ClO)2 oxoclorato (I) de cadmio Co(ClO4)3 tetraoxoclorato (VII) de cobalto(III) Co(NO3)3 nitrato de cobalto (III) Co(NO3)3 trioxonitrato(V) de cobalto(III) CrCl3 cloruro de cromo (III) Cu(BrO3)2 bromato de cobre (II) Cu(BrO3)2 trioxobromato (V) de cobre(II) Cu(BrO4)2 tetraoxobromato (VII) de cobre(II) Cu2SO4 sulfato de cobre (I) Cu2SO4 tetraoxosulfato (VI) de cobre (I) CuSO4 sulfato de cobre (II) CuSO4 tetraoxosulfato (VI) de cobre (II) Fe(NO2)2 nitrito de hierro (II) Fe(NO2)3 dioxonitrato (III) de hierro(III) Fe2(SO4)3 tetraoxosulfato (VI) de hierro (III) FeSO4 tetraoxosulfato (VI) de hierro (II) K 2CrO4 cromato de potasio
- 15. FORMULACIÓN Y NOMENCLATURA QUÍMICA INORGÁNICA nomenc98 Seminario Física y Química pg:15 I.E.S. GRANDE COVIAN K2Cr2O7 dicromato de potasio K2CrO4 tetraoxocromato (VI) de potasio KIO4 peryodato de potasio KIO4 tetraoxoyodato (VII) de potasio KMnO4 permanganato de potasio KNO2 nitrito de potasio LiBrO2 bromito de litio LiBrO2 dioxobromato (III) de litio LiClO4 perclorato de litio LiMnO4 permanganato de litio LiNO2 nitrito de litio MgCr2O7 dicromato de magnesio MgSeO3 trioxoseleniato (IV) de magnesio MgSO3 trioxosulfato (IV) de magnesio MgSO4 sulfato de magnesio MnCl2 cloruro de manganeso (II) MnSO4 tetraoxosulfato (VI) de manganeso (II) Na2CO3 carbonato de sodio Na2CO3 trioxocarbonato (VI) de sodio Na2Cr2O7 dicromato de sodio Na2CrO4 cromato de sodio Na2MnO4 permanganato de sodio Na2SO4 sulfato de sodio Na2SO4 tetraoxosulfato (VI) de sodio Na3AsO4 ortoarseniato de sodio Na3PO4 fosfato de sodio NH4ClO4 perclorato de amonio NH4ClO4 tetraoxoclorato (VII) de amonio Ni(ClO2)2 clorito de níquel(II) Ni(ClO2)2 dioxoclorato (III) de níquel(II) Pb(ClO2)2 clorito de plomo (II) Pb(ClO2)2 dioxocloraot (III) de plomo (II) Sr(NO2)2 dioxonitrato (IV) de estroncio Sr(NO2)2 nitrito de estroncio Zn(NO3)2 nitrato de cinc Zn(NO3)2 trioxonitrato (V) de cinc BaO2 peróxido de bario H2O2 agua oxigenada H2O2 peróxido de hidrógeno Li2O2 peróxido de litio Na2O2 peróxido de sodio SrO2 peróxido de estroncio (NH4)H2PO4 dihidrógenofosfato de amonio Al2(HPO4)3 hidrógenofosfato de aluminio Ba(HCO3)2 hidrógenocarbonato de bario Ca(HCO3)2 hidrógenocarbonato de calcio K2HPO4 hidrógenofosfato de potasio KHSO4 hidrógenosulfato de potasio Na2HPO4 hidrógenofosfato de sodio NaHCO3 hidrógenocarbonato de sodio NaHS hidrógenosulfuro de sodio NaHSO4 hidrógenosulfato de sodio NH4HSO4 hidrógenosulfato de amonio (NH4)2S sulfuro de amonio (NH4)2Se seleniuo de amonio (NH4)Cl cloruro de amonio (NH4)I yoduro de amonio AgBr bromuro de plata AgCl cloruro de plata AgI yoduro de plata AuCl cloruro de oro (I) AuCl3 cloruro de oro (III) BiCl3 cloruro de bismuto (III) CaCl2 cloruro de calcio CaF2 fluoruro de calcio CaI2 yoduro de calcio CdI2 yoduro de cadmio CoBr2 bromuro de cobalto (II) CoTe telururo de cobalto (II) Cs2S sulfuro de cesio Fe2S3 sulfuro de hierro (III) FeCl2 cloruro de hierro (II) FeCl3 cloruro de hierro (III) FeI3 yoduro de hierro (III) Hg(CN)2 cianuro de mercurio (II) KBr bromuro de potasio KCl cloruro de potasio KI yoduro de potasio Na2S sulfuro de sodio Na2Te telururo de sodio NaF fluoruro de sodio NaI yoduro de sodio NH4Br bromuro de amonio NiBr2 bromuro de níquel (II) NiCl2 cloruro de níquel (II) PbI2 yoduro de plomo (II) PbS seleniuro de plomo (II) SnCl2 cloruro de estaño (II) SrF2 fluoruro de estroncio SrS sulfuro de estroncio TiCl3 cloruro de titanio (III)
