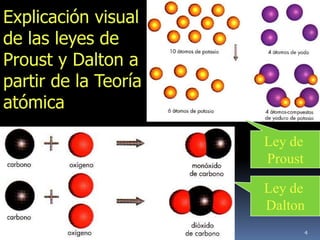
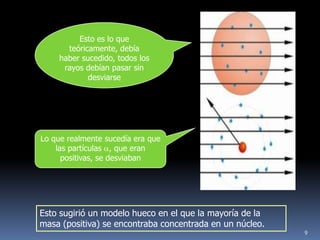
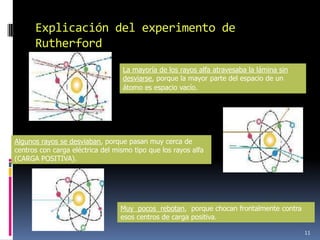
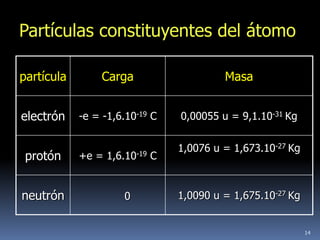
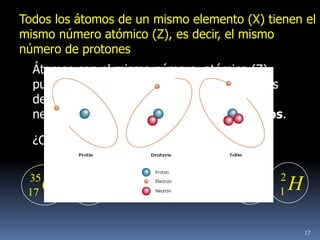
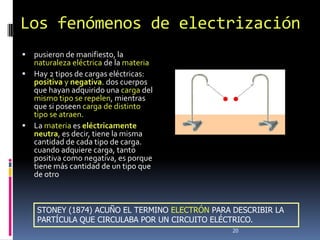
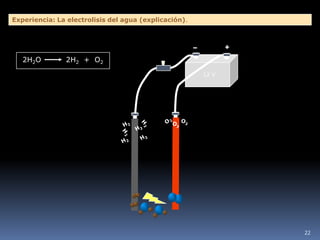
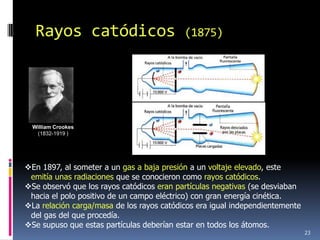
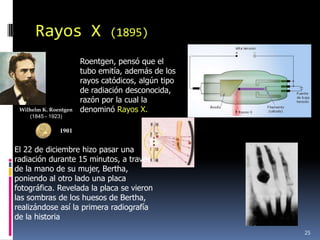
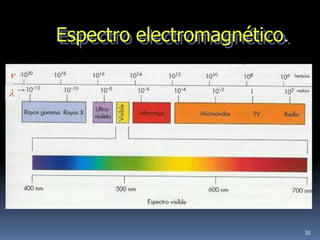
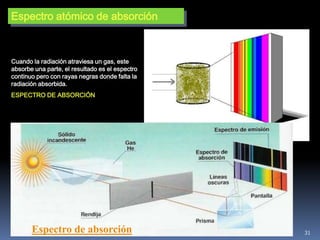
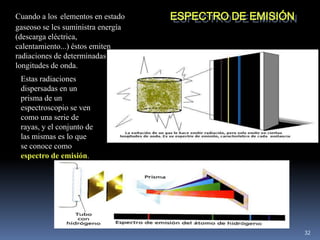
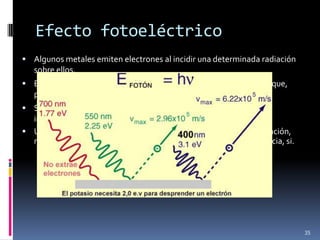
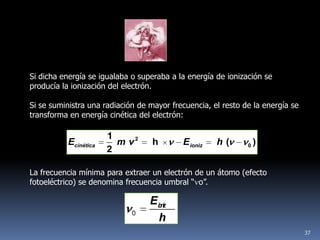
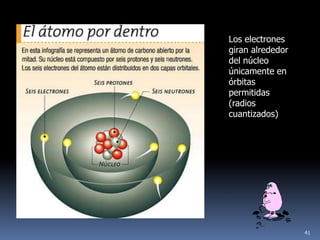
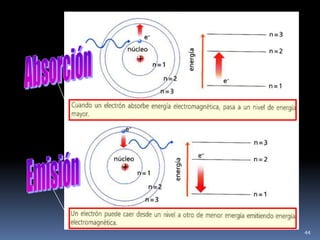
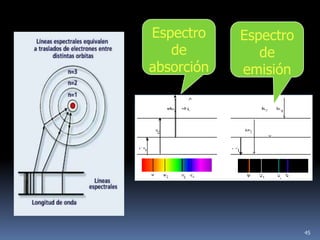
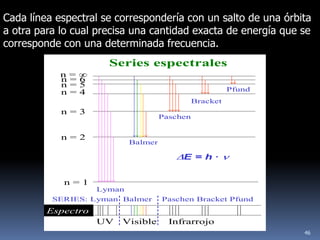
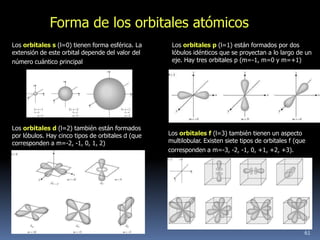
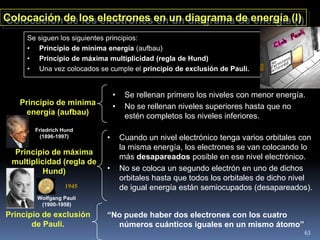
1) Se establecieron las primeras leyes de la química como la ley de conservación de la masa y proporciones definidas. 2) Se descubrió la pila eléctrica y se formuló la hipótesis de Avogadro. 3) Dalton formuló su teoría atómica postulando que los átomos son indivisibles e indestructibles y se combinan en relaciones sencillas.