1 TABLA PERIODICA PARA UNIVERSITARIOS DE EDUCACIÓN Y QUÍMICA PURA.pdf
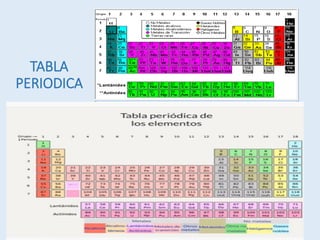
- 2. TABLA PERIODICA Ley periódica Después de muchos intentos de clasificar los elementos, desde Dobereiner (triadas)hasta Mendeleev (periodicidad por masa atómica), Moseley llegó a la conclusión de que si se ordena los elementos por su número atómico, se encuentra propiedades comunes para ciertos elementos, así por ejemplo, el 11, 19, 37, 55 y 87 tienen propiedades comunes que se incrementan o disminuyen según su número atómico y constituyen los metales alcalinos. Gracias a esta conclusión se estableció la Ley periódica para clasificar los elementos en una Tabla periódica: “Las propiedades químicas de los elementos son una función periódica de sus números atómicos crecientes”.
- 3. TRIADAS DE DOBEREINER OCTAVAS DE NEWLAND MASA ATOMICA MENDELEIEV
- 4. Ley de la tabla periódica Moseley Las propiedades físicas y químicas de los elementos son función de su número atómico.
- 5. Ley Periódica La tabla periódica de Moseley y IUPAC (1979) es la conclusión de los diversos intentos que se hicieron para buscar una clasificación natural de los elementos. Esta tabla periódica puede ser de forma corta o forma larga; pero, en cualquiera de sus formas no se debe olvidar que la periodicidad es una función de los números atómicos y por ese motivo que la tabla periódica se clasifica de acuerdo al orden creciente de los mismos.
- 6. LEY PERIÓDICA • Esta ley es la base de la tabla periódica y establece que las propiedades físicas y químicas de los elementos tienden a repetirse de forma sistemática conforme aumenta el número atómico. • El numero atómico indica el numero de protones, pero cuando el átomo esta en estado basal, el numero de protones es igual al numero de electrones. • Establecemos que las propiedades de los elementos están fijadas por el numero de electrones de valencia. • La localización de los electrones esta en base a los cuatro números quánticos
- 7. Los cuatro números quánticos que permiten la localización de los electrones de valencia son: n = numero cuanto principal 1,2,3,4,5,6,7… Por lo tanto la tabla debe representar el nivel energético donde se encuentren los electrones de valencia, y es así ya que en la tabla periódica aparecen como líneas horizontales a los cuales se les designa con el nombre de PERIDOS.
- 8. •Las filas horizontales de la Tabla Periódica son llamadas Períodos. •Contrario a como ocurre en el caso de los grupos de la tabla periódica. •Todos los elementos de un período tienen el mismo número de orbitales, pero diferente numero de electrones de valencia. •Los electrones de valencia se encuentran en el mismo periodo.
- 9. • El segundo numero quántico es el designado como subnivel que nos indica la forma del orbital y tenemos cuatro valores Cuando L es 0 se designa con la letra S que tiene una capacidad de 2 electrones. • Por lo tanto puede haber la probabilidad de que el átomo termine en ns1 y ns2 • Por lo que deberemos encontrar dos columnas en el bloque S
- 10. El segundo valor de L es 1, que se representa con la letra ( p ). •La capacidad máxima de este subnivel es de 6, por lo que debe de haber seis probabilidad, es decir seis columnas, que representen a : np1 , np2, np3, np4, np5, np6
- 11. •El tercer valor de L es 2, que se representa por la letra ( d ). •La capacidad es de 10 electrones, aplicando similar razonamiento tendremos 10 columnas que van del 1 al 10 •De acuerdo a la regla de la AUFBAU el 3d se empieza a llenar a partir del 4s por lo que deberá de encontrarse en el cuarto periodo.
- 12. El ultimo subnivel es el número 3 que representa a la letra f. •Este subnivel presenta una capacidad máxima de 14 electrones •Aplicando similar razonamiento deberá de existir 14 columnas •Si recordamos el 4f se empieza llenar a partir del 6s y el 5f a partir del 7s.
- 13. •Por efectos de diagramación el bloque f es sustraído del cuadrante establecido y colocado en la parte inferior tal como se indica. •Asi mismo el primer elemento de la segunda columna del bloque s, sus propiedades corresponde a los elementos de los gases nobles, por lo que es trasladado a dicha columna.
- 16. Las características de los elementos METALICOS son: • Conducen con facilidad el calor y la electricidad. • Presentan brillo metálico • Generalmente pueden ser laminados o estirados formando alambres, propiedades que se conocen como MALEABILIDAD y DUCTILIDAD. • Por lo regular a temperatura ambiente son sólidos excepto Hg, Ga, Cs y Fr. • Al combinarse con NO METALES ceden electrones por lo que adquieren cargas positivas (CATIONES).
- 17. Los NO METALES presentan las siguientes características: • Son malos conductores del calor y la electricidad. • No son maleables ni dúctiles. • Reciben electrones al combinarse con los METALES adquiriendo así cargas NEGATIVAS (ANIONES
- 18. •Algunos elementos suelen comportarse según las condiciones como metales o como no metales; a estos se les conoce como METALOIDES.
- 19. Los grupos adquieren nombres particulares, designado generalmente por alguna de sus propiedades sobresaliente e identificatorias
- 21. GRUPOS El hidrógeno aunque se ubica en el grupo 1 no es un metal alcalino. Grupo 1 o 1A .- Grupo 2 o IIA.- Grupo 3 o IIIB.- Grupo 4 o IVB.- Grupo 5 o VB.- Grupo 6 o VIB.- Grupo 7 o VIIB.- Grupos 8, 9 y 10 o VIIIB Grupo 11 o IB.- Grupo 12 o IIB.- Grupo 13 o IIIA.- Grupo 14 o IVA.- Grupo 15 o VA.- Grupo 16 o VIA.- Grupo 17 o VIIA.- Grupo 18 o VIIIA.- Metales alcalinos: Li , Na. K, Rb, Cs. Fr. Metales alcalinotérreos: Be. Mg. Ca, Sr. Ba. Ra. Grupo del escandio: Sc. Y, La. Ac Grupo del titanio: Ti, Zr. Hf. Grupo del vanadio: V, Nb, Ta Grupo del cromo: Cr, Mo, W Grupo del manganeso: Mn, Tc, Re Fe. Co, Ni; Ru. Rh, Pd y Os, Ir, Pt Grupo del cobre: Cu, Ag, Au Grupo del cinc: Zn, Cd, Hg Grupo del boro: B, Al, Ga, In, TI. Grupo del carbono: C. Si. Ge. Sn, Pb Grupo del nitrógeno: N, P, As, Sb, Bi Calcógenos o grupo del oxigeno: O, S, Se, Te, Po. Halógenos: F, Cl, Br, I, At Gases nobles: He, Ne, Ar, Kr, Xn, Rn
- 22. Otro sistema es empleando el sistema tradicional El que agrupa a los elementos en dos bloques : El A que corresponde a los elementos de las columnas “s” y a los elementos de la columnas “p , los que se enumeran del I al VIII en romanos Se les conoce también como elementos representativos. El segundo bloque es identificado con la letra B, las columnas son enumeradas del I al VIII • Como se podrá observar los elementos de los periodos 6 y 7 de las columnas de los elementos f se agrupan dentro del bloque f
- 25. A las columnas verticales de la Tabla Periódica se les conoce como grupos. •Todos los elementos que pertenecen a un grupo tienen la misma valencia, y por ello, tienen características o propiedades similares entre si. •Por ejemplo los elementos en el grupo IA tienen valencia de 1 (un electrón su último orbital) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. •Los elementos en el último grupo de la derecha son los Gases Nobles, los cuales tienen su último orbital lleno (regla del octeto) y por ello son todos extremadamente no-reactivos.
- 28. La electronegatividad aumenta hacia la derecha y hacia arriba. • Pauling construyó una escala de electronegatividades de los elementos que van del 0 al 4. -Metales: electronegatividad muy pequeña (electropositivos) -No metales: electronegatividad elevada (electronegativos) • El valor máximo es 4 que es el valor asignado al flúor, el elemento más electronegativo. • El elemento menos electronegativo es el francio que tiene una electronegatividad de 0,7.
- 29. ELECTRONEGATIVIDAD H Li Na K Rb Cs Fr a u m e n t a d i s m i n u y e Rn Xe Kr Ar Ne He a u m e n t a
- 31. ELECTRONEGATIVIDAD • En los grupos la electronegatividad va disminuyendo de arriba hacia abajo conforme aumenta el número atómico, mientras que en los periodos se incrementa de izquierda a derecha. • Los elementos más electronegativos están en el lado derecho superior de la tabla (Halógenos F) y los menos electronegativos se ubican en el lado inferior izquierdo (metales alcalinos, Fr).
- 32. ELECTROAFINIDAD Es el cambio de energía que experimenta un átomo en estado gaseoso cuando gana un electrón y se convierte en un ión negativo. Se dice cambio de energía porque en algunos casos libera energía y en otros se necesita energía, por ejemplo: • Br(g) + 1e- → Br- (g) + 322 kJ/mol (emite) • O(g) + 1e- → O- (g) + 142 kJ/mol (emite) • O(g) + 1e- → O2- (g) - 378 kJ/mol (absorbe)
- 33. ELECTROAFINIDAD • Considerando la afinidad como energía liberada cuando un átomo gana un electrón la tendencia en la tabla periódica es la siguiente. • En un grupo la afinidad electrónica aumenta de abajo hacia arriba. • En un periodo la afinidad electrónica aumenta de izquierda a derecha. • La afinidad electrónica es lo contrario de la energía de ionización. Los elementos con afinidades electrónicas muy negativas ganan fácilmente electrones, como los halógenos.
- 34. ELECTROAFINIDAD H Li Na K Rb Cs Fr a u m e n t a a u m e n t a Rn Xe Kr Ar Ne He Átomo Electroafinidad kJ/mol F 328,0 Cl 348,0 Br 324,0 I 295,0
- 35. RADIO ATÓMICO El tamaño de un átomo está directamente relacionado con el radio atómico. El radio atómico de un átomo individual no puede medirse directamente, porque no existe aislado. Por lo tanto el radio atómico se define como la mitad de la distancia entre los núcleos de dos átomos adyacentes de una molécula homonuclear, como Cl2, H2, Br2, etc.
- 36. El radio atómico debe obtenerse midiendo las distancias entre átomos en compuestos químicos. Por ejemplo tomemos la molécula de Bromo Br2. El radio del átomo Br es " la mitad de la distancia" entre los núcleos, que se puede medir experimentalmente y cuyo valor es Br-Br = 2,28 Å. Mediciones de este tipo han permitido conocer prácticamente todos los radios atómicos de los elementos.
- 38. H Li Na K Rb Cs Fr Rn Xe Kr Ar Ne He el radio atómico disminuye a u m e n t a RADIO ATÓMICO En la tabla periódica el radio atómico en los grupos aumenta de arriba hacia abajo, así en el primer grupo el Li es el más pequeño y el Fr el más grande. Esto se debe a que el electrón del último nivel se va alejando del núcleo conforme se incrementa el número atómico, al ocupar niveles de mayor energía.
- 39. En un período el radio atómico disminuye de izquierda a derecha, esta tendencia no parece lógica ya que en los períodos también se va incrementando el número atómico; pues bien, en un período el número de niveles ocupados es el mismo, pero conforme se va avanzando a la derecha se incrementa el número de protones y el número de electrones, aumentando así la atracción entre el núcleo y la nube electrónica, causando una contracción del átomo y por lo tanto en un periodo es más pequeño el átomo mientras mayor sea el número atómico.
- 40. ENERGÍA DE IONIZACIÓN Es la energía necesaria que se debe dar a un átomo gaseoso para arrancarle un electrón y así formar un ión. Ejemplos: • Liº (g) + 520 kJ/mol → Li+ (g) + e- • Kº (g) + 418,8 kJ/mol → K+ (g) + e- • Caº (g) + 589,5 kJ/mol → Ca+ (g) + e-
- 41. X (g) ------> X+ (g) + e-
- 42. Si se desea arrancar más de un electrón a un átomo neutro, entonces usaremos los términos: 1ra energía de ionización, 2da energía de ionización, etc. Esta energía se incrementa al tratar de sacar más electrones. por ejemplo: (1ra) Coº(g) + 757,3 kJ/mol → Co+ (g) + e- (2da) Coº(g) + 1 644 kJ/mol → Co+2(g) + e- (3ra) Coº(g) + 2 231,1 kJ/mol →Co3+ (g) + e- Al (g) ---------> Al1+(g) + 580 kJ/mol Al+(g) ---------> Al2+(g) + 1815 kJ/mol Al2+(g) ---------> Al3+(g) + 2740 kJ/mol Al3+(g) ---------> Al4+(g) + 11600 kJ/mol
- 43. •La energía necesaria para retirar el primer electrón más débilmente unido, se conoce como La Primera Energía de Ionización (EI 1) . • El retiro del segundo electrón requiere la energía (EI 2) y así sucesivamente.
- 44. ENERGÍA DE IONIZACIÓN H Li Na K Rb Cs Fr a u m e n t a a u m e n t a Rn Xe Kr Ar Ne He En un grupo, la energía de ionización de los átomos aumenta de abajo hacia arriba. Esto se debe a que al aumentar el número de niveles el electrón periférico se encuentra más alejado del núcleo y por consiguiente tendrá menor fuerza de atracción. En un período la energía de ionización de los átomos aumenta de izquierda a derecha. Esto se debe a que aumenta la carga nuclear y de igual manera la fuerza de atracción de los electrones. Los elementos con bajas energías de ionización pierden electrones más fácilmente. Formando iones positivos.
- 45. RESUMIENDO
- 46. TENDENCIAS DEL PUNTO DE EBULLICION Y PUNTO DE FUSIÓN • En un grupo los puntos de fusión y de ebullición se incrementa de arriba hacia abajo, por ejemplo en los halógenos Cl2, Br2 y I2. • En un periodo, para los metales aumentan de izquierda a derecha y en los no metales se incrementan de derecha a izquierda.
- 47. CARÁCTER METÁLICO Y NO METÁLICO A lo largo de cualquier periodo, las propiedades físicas y químicas de los elementos cambian de manera gradual de metálicas a no metálicas. La comparación de las propiedades de los elementos del mismo grupo es más válida si se trata de elementos del mismo tipo en relación con su carácter metálico.
- 48. VALENCIA Es el número de electrones que un átomo puede ganar o perder para conseguir una distribución electrónica de gas noble, cómo el máximo de electrones en último nivel ocupado o nivel de valencia es 8, entonces, las valencias fluctúan entre 1 y 4 Cada elemento sólo tiene una valencia y depende del grupo en que se encuentra.
- 49. Es el número aparente de electrones ganados o perdidos en promedio por los átomos de un elemento cuando forma un compuestos. Así por ejemplo el Na en el NaCl pierde un electrón por átomo por lo tanto su número de oxidación es +1. El O en el H2O aparentemente gana 2 electrones por lo tanto su número de oxidación es -2.