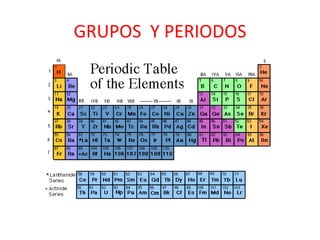
Este documento presenta información sobre la tabla periódica, incluyendo su estructura, grupos y periodos. Explica las propiedades de los elementos representativos, no representativos y gases nobles. También describe cómo varían propiedades como el radio atómico, potencial de ionización y afinidad electrónica a través de la tabla.