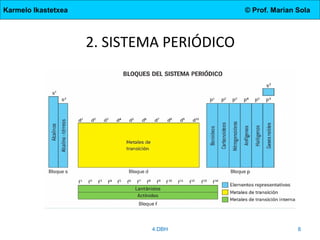
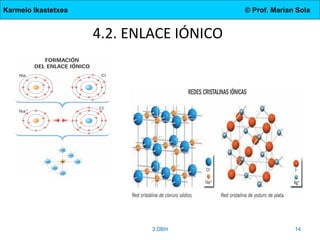
Este documento describe los elementos químicos, el sistema periódico, los tipos de enlace (iónico, covalente y metálico), y las propiedades de los compuestos formados por cada tipo de enlace. Explica que los elementos son sustancias formadas por átomos con el mismo número atómico y cómo el sistema periódico los organiza en períodos y grupos con propiedades similares. Además, define moléculas, cristales, y las características de los compuestos iónicos, moleculares, cristalinos coval