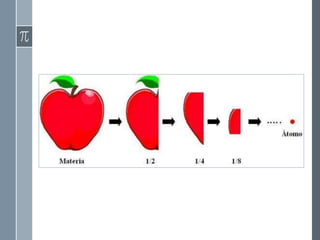
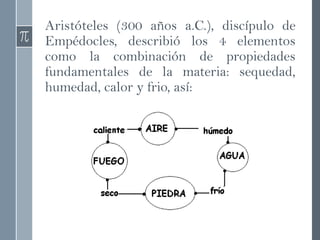
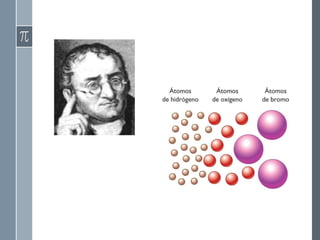
Este documento describe la evolución histórica de las teorías atómicas, desde las primeras concepciones filosóficas de los átomos en la antigua Grecia hasta los modelos atómicos modernos. Explica las teorías atómicas de Dalton, Thomson, Rutherford y Bohr, las cuales propusieron modelos cada vez más precisos de la estructura atómica basados en nuevos descubrimientos experimentales.