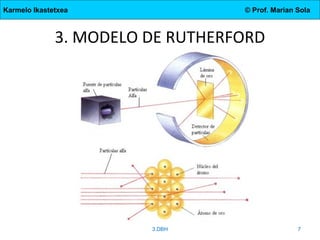
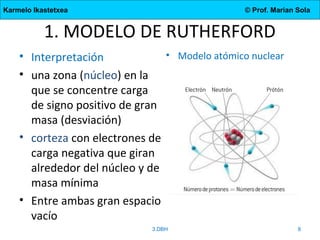
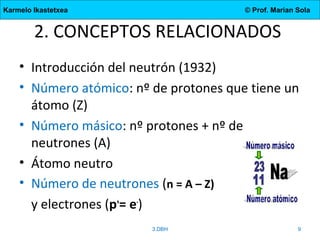
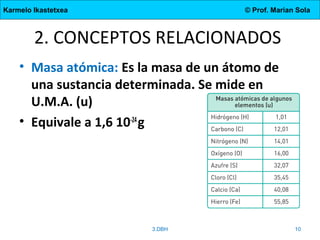
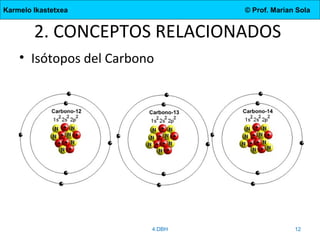
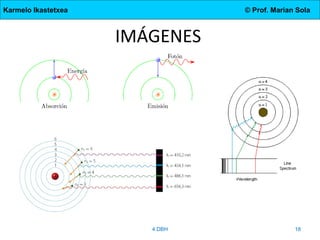
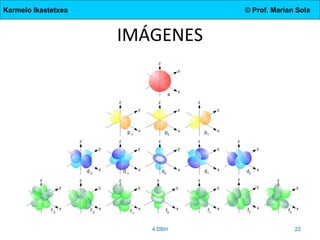
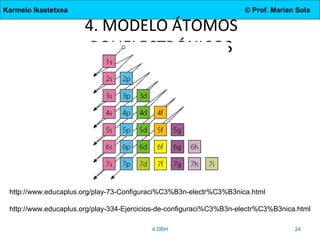
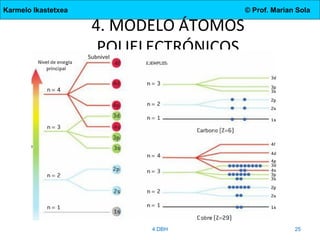
El documento describe la evolución de los modelos atómicos desde la antigua Grecia hasta el modelo actual. Comienza con las teorías de Demócrito y Aristóteles, luego describe los modelos de Dalton, Thomson, Rutherford, y Bohr. El modelo de Rutherford introdujo el concepto del núcleo atómico central. El modelo de Bohr describió los niveles de energía de los electrones y las órbitas permitidas. Los modelos posteriores incluyeron subniveles de energía y la configuración electrónica de los átomos.