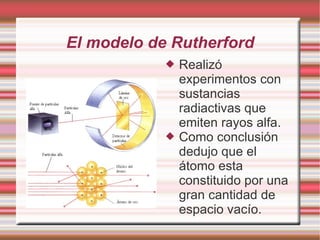
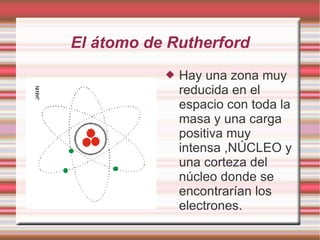
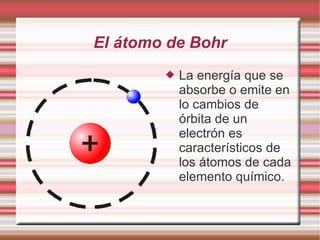
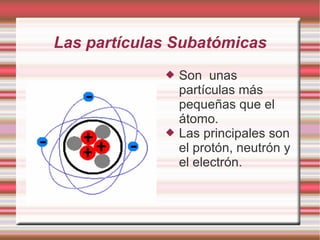
Este documento describe la evolución de los modelos atómicos a través del tiempo, incluyendo el modelo de Dalton que propuso que la materia está compuesta de átomos indivisibles, el modelo de Thomson que propuso que los átomos consisten en una esfera positiva con electrones distribuidos uniformemente, el modelo de Rutherford que propuso que los átomos consisten principalmente de espacio vacío con un núcleo denso de carga positiva, y el modelo de Bohr que propuso que los electrones orbitan en niveles de energía distint