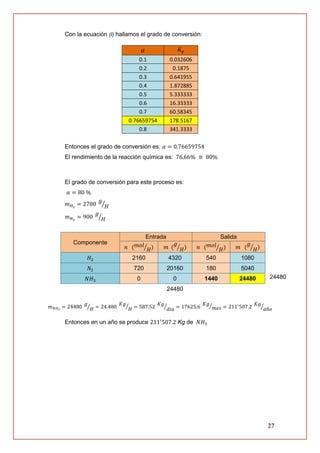
El documento detalla la obtención de amoniaco a partir de gas de síntesis (H2) derivado del gas natural, utilizando el método Haber-Bosch, que es el más común a nivel mundial. El amoniaco es vital en la industria química, principalmente para la producción de fertilizantes y otros usos industriales, y su costo energético afecta a diversos sectores. Se discuten también tecnologías para la producción de H2, así como las propiedades y aplicaciones del gas natural y del hidrógeno en la industria.








![10
1.5. Tecnologías de obtención del H2
• Electrólisis del agua
La electrólisis del agua es un método de obtención de hidrógeno no muy
usado debido a que resulta al menos dos veces más caro que el hidrógeno
obtenido por el reformado del gas natural [9]. Sin embargo, es de un gran
interés ya que es un método bastante limpio y que podría ser usado como
complemento para la energía producida por centrales solares y eólicas, y
además, produce un hidrógeno de elevada pureza.
• Reformado con vapor
El proceso de reformado con vapor funciona preferentemente sobre
hidrocarburos ligeros, es decir, con puntos de ebullición inferiores a 200°C,
que deben ser limpiados de toda impureza (azufre, arsénico, halógenos,
entre otros) antes de su procesamiento. La carga a utilizar puede ser gas
natural, metano o gas licuado de petróleo. Básicamente, el proceso consiste
en la exposición de la carga a vapor de agua a alta temperatura y a una
presión moderada. Como resultado de la reacción química se obtiene
fundamentalmente hidrógeno, monóxido y dióxido de carbono y otros
compuestos. Estas reacciones ocurren generalmente a temperaturas
comprendidas entre los 800 y 950°C con presiones entre 1,5 a 3,0 MPa.
• Oxidación parcial
El hidrocarburo se mezcla con oxígeno o vapor de agua, se calientan, se
mezclan y queman dentro del reactor a unos 1100°C. La eficiencia de este
método es relativamente elevada, pero menos eficiente que el reformado por
vapor debido a que opera a elevadas temperaturas y existe el problema de
la recuperación del calor. Tiene unos costes de inversión y operación
elevados si se opera con oxígeno puro. Sin embargo, el uso de aire en vez
de vapor, y debido a que es una reacción exotérmica, hace que no se
necesite aporte de energía externa durante el proceso.
• Reformado autotérmico
Es una combinación de la oxidación parcial y la de reformado por vapor de
forma conjunta. Con la correcta combinación de alimentación de entrada, el
calor de reacción de la oxidación parcial es suficiente para que se dé la
reacción de reformado por vapor. El hidrocarburo reacciona con el vapor de
agua y con el aire para producir un gas rico en hidrógeno. Los inconvenientes
que presenta este método tienen que ver con el tamaño de todo el equipo en
conjunto debido a que requieren un sistema de recuperación del calor.3
3
http://hrudnick.sitios.ing.uc.cl/alumno14/hidrog/tecnologias.htm](https://image.slidesharecdn.com/amoniaco-170824043952/85/AMONIACO-OBTENCION-A-PARTIR-DEL-GAS-DE-SINTESIS-H2-10-320.jpg)



![14
∆𝑼 𝟐𝟗𝟖 °𝑲 = (𝟐∆𝑼 𝑵𝑯 𝟑
)
𝒑𝒓𝒐𝒅
− (𝟏∆𝑼 𝑵 𝟐
+ 𝟑∆𝑼 𝑯 𝟐
)
𝒓𝒆𝒂𝒄𝒕
……….(IV)
∆𝑈298 °𝐾 = (2𝑚𝑜𝑙 (−48.666
𝐾𝐽
𝑚𝑜𝑙
)) − (1𝑚𝑜𝑙 (−2.476
𝐾𝐽
𝑚𝑜𝑙
) + 3𝑚𝑜𝑙 (−2.476
𝐾𝐽
𝑚𝑜𝑙
))
∆𝑈298 °𝐾 = −87.428
𝐾𝐽
𝑚𝑜𝑙
= −0.087428
𝐽
𝑚𝑜𝑙
Obteniendo: ∆𝐶 𝑝 = 𝑓(𝑇)
Componentes 𝐶 𝑝(𝑇) ( 𝐽
𝑚𝑜𝑙. °𝐾⁄ )
𝑁2 𝐶 𝑝 𝑁2
= 29.342 − 3.5395𝑥10−3
𝑇 + 1.0076𝑥10−5
𝑇2
𝐻2 𝐶 𝑝 𝐻2
= 25.399 + 2.0178𝑥10−2
𝑇 + (−3.8549𝑥10−3
𝑇2
)
𝑁𝐻3 𝐶 𝑝 𝑁𝐻3
= 33.573 − 1.2581𝑥10−2
𝑇 + 8.8906𝑥10−8
𝑇2
Con la siguiente formula:
∆𝐶 𝑝 = (2∆𝐶 𝑝 𝑁𝐻3
)
𝑝𝑟𝑜𝑑
− (1∆𝐶 𝑝 𝑁2
+ 3∆𝐶 𝑝 𝐻2
)
𝑟𝑒𝑎𝑐𝑡
∆𝐶 𝑝 = [2(33.573 − 1.2581𝑥10−2
𝑇 + 8.8906𝑥10−8
𝑇2
)]
− [(29.342 − 3.5395𝑥10−3
𝑇 + 1.0076𝑥10−5
𝑇2) + 3(25.399
+ 2.0178𝑥10−2
𝑇 + (−3.8549𝑥10−3
𝑇2
))]
∆𝐶 𝑝 = −38.393 − 0.08216𝑇 + 0.0115548𝑇2
Reemplazamos en III:
∆𝑈 = ∆𝑈298 °𝐾 + ∫ (∆𝐶 𝑝 − 𝑅)
𝑇
298 °𝐾
𝑑𝑇 ; 𝑅 = 8.31 (
𝐽
𝑚𝑜𝑙. °𝐾⁄ )
∆𝑈 = −0.087428
𝐽
𝑚𝑜𝑙
+ ∫ ((−38.393 − 0.08216𝑇 + 0.0115548𝑇2
) − 8.31
𝐽
𝑚𝑜𝑙. °𝐾
)
𝑇
298 °𝐾
𝑑𝑇
∆𝑈 = −0.087428 + ((−38.393 − 8.31)(𝑇 − 298) +
(−0.08216)
2
(𝑇2
− 2982
) +
0.0115548
3
(𝑇3
− 2983
))
∆𝑈 = −84361.6961 − 46.703𝑇 − 0.04108𝑇2
+ 0.0038516𝑇3
Tabulando:
𝑇 (°𝐾) ∆𝑈 ( 𝐽
𝑚𝑜𝑙⁄ )
100 -85591.20
200 -64532.70
300 1923.40
400 136886.70
500 363466.80
600 704773.30
700 1183915.80
750 1482397.30
800 1824003.90](https://image.slidesharecdn.com/amoniaco-170824043952/85/AMONIACO-OBTENCION-A-PARTIR-DEL-GAS-DE-SINTESIS-H2-14-320.jpg)
![17
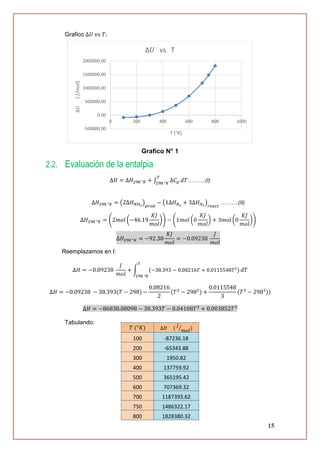
Tabulando:
𝑇 (°𝐾) ∆𝑆 (
𝐽
𝑚𝑜𝑙. °𝐾⁄ )
100 -595.3
200 -456.9
300 -191.8
400 193.3
500 696.5
600 1316.7
700 2053.6
750 2465.7
800 2906.8
Grafico ∆𝑆 𝑣𝑠 𝑇:
Grafico N° 3
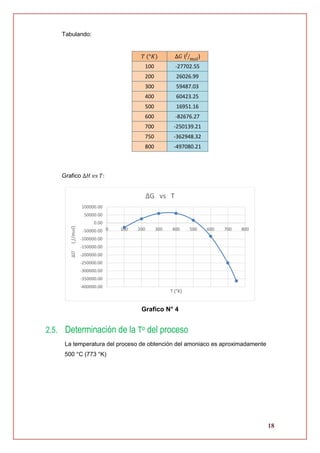
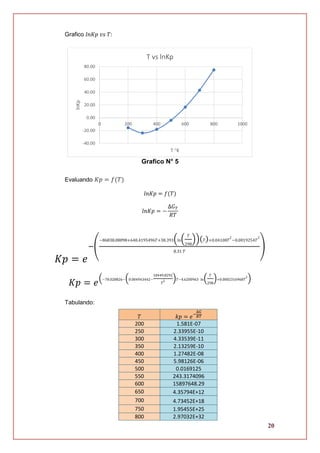
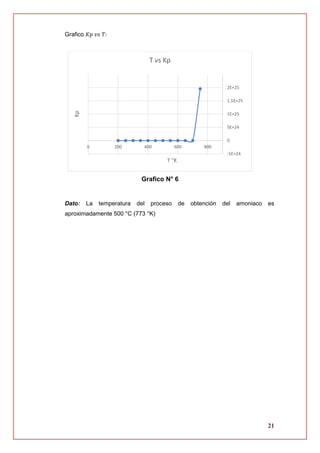
2.4. Evaluación de la energía libre de Gibbs
∆𝐺 = 𝑓(𝑇)
∆𝐺 = ∆𝐻 𝑇 − 𝑇∆𝑆 𝑇
∆𝐺 = [−86838.08098 − 38.393𝑇 − 0.04108𝑇2
+ 0.003852𝑇3]
− 𝑇 [−686.8125496 − 38.393 (ln (
𝑇
298
)) − 0.08216𝑇 + 0.0057774𝑇2
]
∆𝐺 = −86838.08098 − 38.393𝑇 − 0.04108𝑇2
+ 0.003852𝑇3
+ 686.8125496𝑇
+ 38.393 (ln (
𝑇
298
)) (𝑇) + 0.08216𝑇2
− 0.0057774𝑇3
∆𝐺 = −86838.08098 + 648.4195496𝑇 + 38.393 (ln (
𝑇
298
))(𝑇) + 0.04108𝑇2
− 0.0019254𝑇3
-1000.0
-500.0
0.0
500.0
1000.0
1500.0
2000.0
2500.0
3000.0
3500.0
4000.0
0 100 200 300 400 500 600 700 800 900
∆S(𝐽⁄(𝑚𝑜𝑙.°𝐾))
T (°K)
∆S vs T](https://image.slidesharecdn.com/amoniaco-170824043952/85/AMONIACO-OBTENCION-A-PARTIR-DEL-GAS-DE-SINTESIS-H2-17-320.jpg)