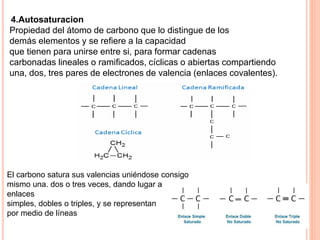
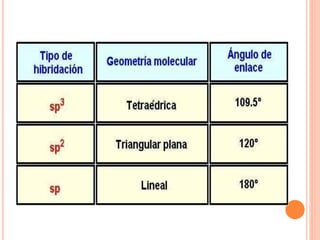
El documento describe las propiedades físicas, químicas y generales del átomo de carbono. Físicamente, es insoluble en agua, inodoro, insípido y más denso que el agua, excepto el diamante. Químicamente, se combina con otros elementos para formar una variedad de compuestos. Generalmente, el carbono es tetravalente y forma enlaces covalentes con otros átomos, lo que le permite unirse a sí mismo en cadenas y formar una amplia gama de compuestos orgánicos.