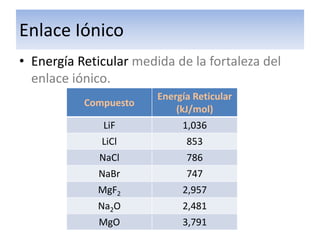
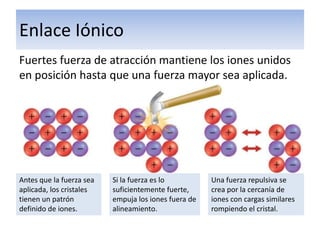
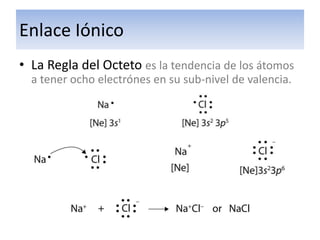
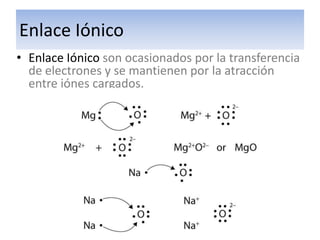
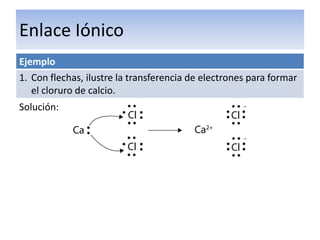
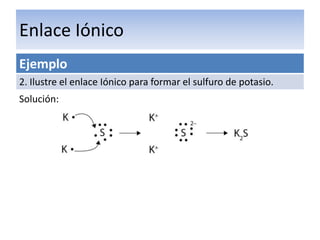
El documento explica el enlace iónico, incluyendo la regla del octeto, la formación de iones a través de la transferencia de electrones, y que la atracción entre iones cargados opuestamente crea un fuerte enlace iónico. Proporciona ejemplos de enlaces iónicos como el cloruro de calcio y el sulfuro de potasio, y evalúa conceptos sobre enlaces iónicos a través de preguntas.

![Enlace Iónico
Autoevaluación
1. Cuál de las siguientes configuraciones electrónicas
tiene mayor posibilidad de reaccionar perdiendo un
electrón?
a. 1s22s22p6
b. [He]2s22p5
c. 1s22s22p63s23p5
d. 1s22s22p63s23p64s1](https://image.slidesharecdn.com/enlaceinico-120723231647-phpapp01/85/Enlace-ionico-6-320.jpg)


![Enlace Iónico
Autoevaluación
4. Cuál es la configuración electrónica de un átomo de
sodio después de perder un electrón?
a. 1s22s22p6
b. [He]2s22p5
c. 1s22s22p63s1
d. 1s22s22p63s2](https://image.slidesharecdn.com/enlaceinico-120723231647-phpapp01/85/Enlace-ionico-9-320.jpg)