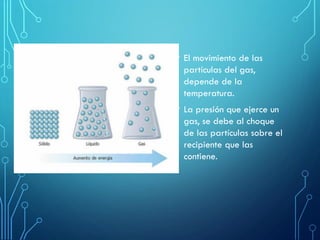
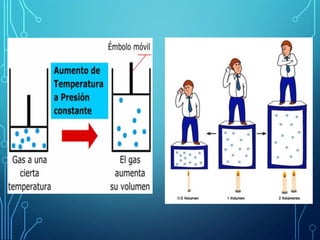
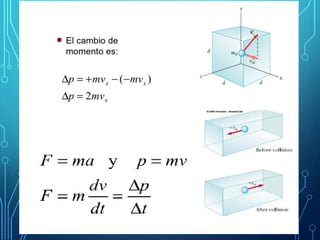
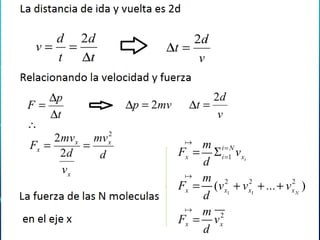
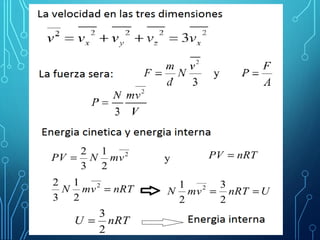
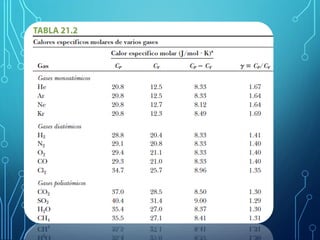
Este capítulo trata sobre la teoría cinética de los gases ideales. Explica el modelo molecular de un gas ideal y sus suposiciones clave. También cubre el cálculo del calor específico molar de un gas ideal, procesos adiabáticos para gases ideales y la distribución de la energía entre los diferentes modos de libertad molecular. Incluye ejemplos numéricos para ilustrar los conceptos.