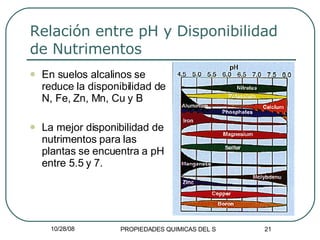
El documento describe las propiedades químicas de los suelos relacionadas con el pH. Explica que el pH indica el grado de acidez o alcalinidad de un suelo y cómo afecta la disponibilidad de nutrientes. También describe la diferencia entre acidez activa y potencial, y cómo factores como la presencia de carbonatos, la saturación de bases intercambiables, y la lluvia ácida influyen en el pH del suelo. Finalmente, resume cómo el pH afecta específicamente la disponibilidad de nutrientes como N, P,

![Principios de pH del Suelo La acidez de una solución acuosa se expresa en términos de pH. El pH se define como el negativo del logaritmo de la concentración activa de iones de hidrógeno. pH = -log [H + ] Es la medida individual más importante de un suelo](https://image.slidesharecdn.com/capitulo-4-a-1225200297267824-8/85/Capitulo-4-A-2-320.jpg)