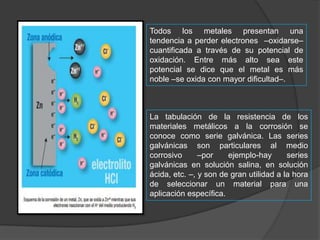
La corrosión se define como el deterioro de un material a consecuencia de un ataque electroquímico por su entorno. Es un fenómeno que afecta a todos los materiales y ambientes, involucrando nociones de química y física. Para que ocurra la corrosión se requiere la presencia de un material que ceda electrones, uno que los acepte, y un medio conductor de iones que completa el circuito eléctrico. El estudio de la corrosión permite predecir el comportamiento a largo plazo de los metales