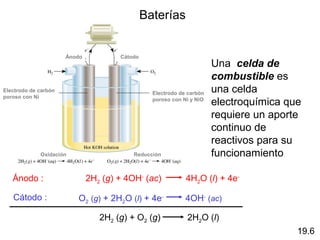
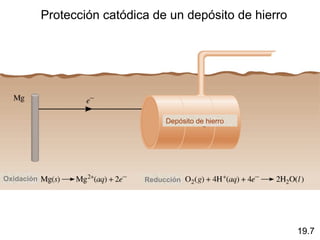
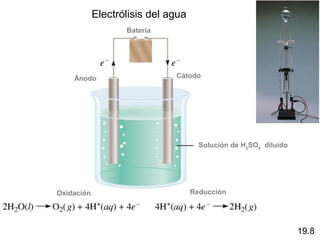
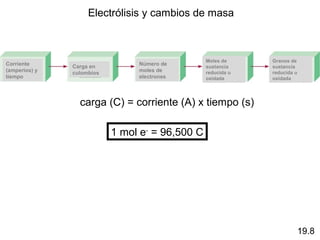
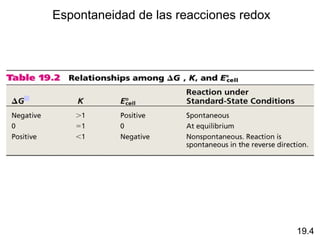
Las reacciones electroquímicas son procesos de oxidación-reducción en los que la energía liberada por una reacción espontánea se convierte en electricidad o la energía eléctrica se usa para causar una reacción no espontánea. El documento explica conceptos clave como el número de oxidación, el balanceo de ecuaciones redox, las celdas electroquímicas y los potenciales estándares de electrodo, que miden la tendencia de una sustancia a oxidarse o reducirse.





![Celdas electroquímicas
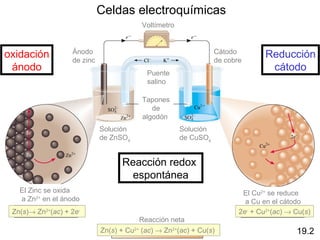
La diferencia en el potencial
eléctrico entre el ánodo y el
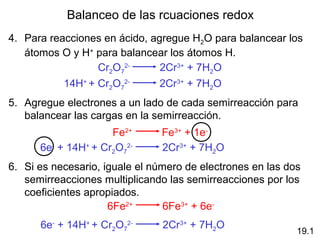
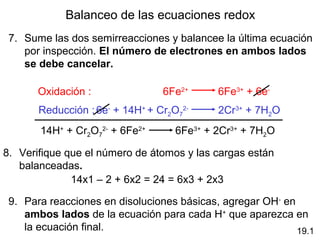
cátodo se llama:
voltaje de la celda
• fuerza electromotriz (fem)
• potencial de celda
Diagrama de celda
Zn (s) + Cu2+ (ac) Cu (s) + Zn2+ (ac)
[Cu2+] = 1 M & [Zn2+] = 1 M
Zn (s) | Zn2+ (1 M) || Cu2+ (1 M) | Cu (s)
ánodo cátodo
19.2](https://image.slidesharecdn.com/diapositivas191-130331161430-phpapp02/85/Electroquimica-9-320.jpg)



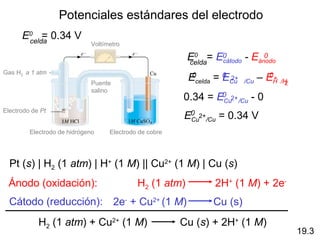





![Ocurrirá la siguiente reacción en forma espontánea a 250C
si [Fe2+] = 0.60 M y [Cd2+] = 0.010 M?
Fe2+ (aq) + Cd (s) Fe (s) + Cd2+ (aq)
Oxidación : Cd Cd2+ + 2e-
n=2
Reducción : 2e- + Fe2+ 2Fe
E0 = E0 2+ /Fe – ECd 2+
Fe
0
/Cd
E0 = -0.44 – (-0.40) 0.0257 V
E = E0 - ln Q
n
E0 = -0.04 V
0.0257 V 0.010
E = -0.04 V - ln
2 0.60
E = 0.013
E>0 Espontánea
19.5](https://image.slidesharecdn.com/diapositivas191-130331161430-phpapp02/85/Electroquimica-20-320.jpg)