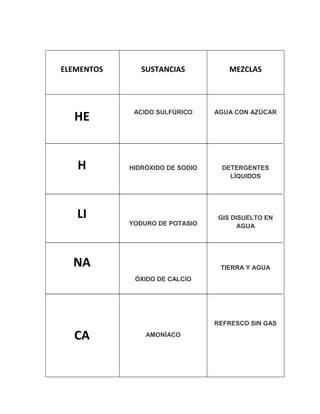
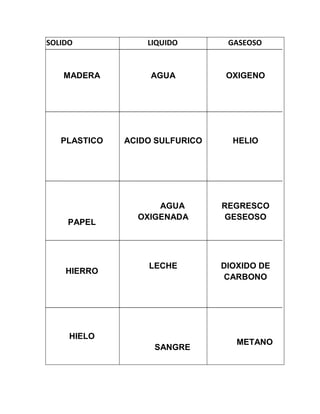
Este documento proporciona información sobre elementos, sustancias, mezclas, y los tres estados de la materia (sólido, líquido y gaseoso). Define elementos químicos, sustancias químicas y mezclas químicas. Describe las propiedades de los sólidos, líquidos y gases. Explica que la cohesión molecular determina el estado de la materia y cómo las moléculas se comportan en cada estado.