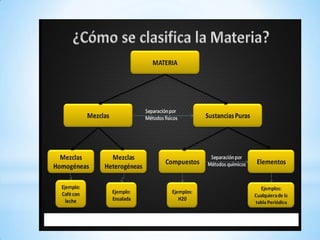
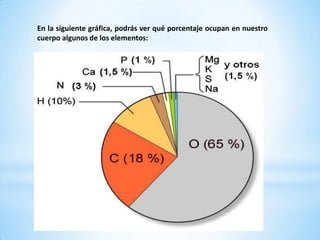
El documento proporciona una introducción a la química. Define materia y explica sus características y los tres estados de agregación (sólido, líquido y gaseoso). También describe sustancias puras como elementos y compuestos, y mezclas homogéneas y heterogéneas. Además, explica fenómenos físicos y químicos y las propiedades físicas y químicas de la materia.