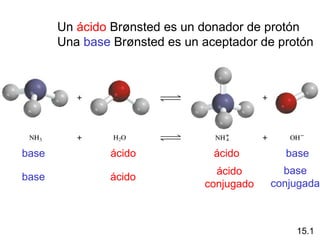
Este documento proporciona información sobre ácidos y bases. Brevemente describe que los ácidos tienen sabor agrio y reaccionan con metales y carbonatos para producir hidrógeno y dióxido de carbono respectivamente. Las bases tienen sabor amargo y muchos jabones contienen bases. También define ácidos y bases de Arrhenius y Brønsted-Lowry y explica las propiedades del agua como ácido-base débil y la relación entre pH, pOH e ionización del agua.



![Propiedades ácido-base del agua
H2O (l) H+ (ac) + OH- (ac)
autoionización del agua
+ + H -
H O + H O [ H O H ] O
H H H
ácido
base
conjugado
H2O + H2O H3O+ + OH-
ácido base
conjugada
15.2](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-5-320.jpg)
![El producto iónico del agua
[H+][OH-]
H2O (l) H+ (ac) + OH- (ac) Kc = [H2O] =constante
[H2O]
Kc[H2O] = Kw = [H+][OH-]
La constante del producto iónico (Kw) es el producto de las
concentraciones molares de los iones H+ y OH- a una
temperatura particular.
La disolución es
[H+] = [OH-] neutra
At 250C [H+] > [OH-] ácida
Kw = [H+][OH-] = 1.0 x 10-14
[H+] < [OH-] básica
15.2](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-6-320.jpg)
![¿Cuál es la concentración de los iones OH- en una
disolución HCl cuya concentración de ion hidrógeno es 1.3
M?
Kw = [H+][OH-] = 1.0 x 10-14
[H+] = 1.3 M
Kw 1 x 10-14
[OH-] = = = 7.7 x 10-15 M
[H+] 1.3
15.2](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-7-320.jpg)
![El pH: una medida de la acidez
pH = -log [H+]
La disolución es A 250C
neutra [H+] = [OH-] [H+] = 1 x 10-7 pH = 7
ácida [H+] > [OH-] [H+] > 1 x 10-7 pH < 7
básica [H+] < [OH-] [H+] < 1 x 10-7 pH > 7
pH [H+]
15.3](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-8-320.jpg)
![pOH = -log [OH-]
[H+][OH-] = Kw = 1.0 x 10-14
-log [H+] – log [OH-] = 14.00
pH + pOH = 14.00
15.3](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-9-320.jpg)
![El pH del agua de lluvia recolectada en una cierta región
del noreste de Estados Unidos en un día particular fue
4.82. ¿Cuál es la concentración del ion H+ del agua de
lluvia?
pH = -log [H+]
[H+] = 10-pH = 10-4.82 = 1.5 x 10-5 M
La concentración de iones OH- de una muestra de sangre
es 2.5 x 10-7 M. ¿Cuál es el pH de la sangre?
pH + pOH = 14.00
pOH = -log [OH-] = -log (2.5 x 10-7) = 6.60
pH = 14.00 – pOH = 14.00 – 6.60 = 7.40
15.3](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-10-320.jpg)





![¿Cuál es el pH de una disolución 2 x 10-3 M HNO3?
HNO3 es un ácido fuerte: 100% disociación .
Inicial 0.002 M 0.0 M 0.0 M
HNO3 (ac) + H2O (l) H3O+ (ac) + NO3- (ac)
Final 0.0 M 0.002 M 0.002 M
pH = -log [H+] = -log [H3O+] = -log(0.002) = 2.7
¿Cuál es el pH de una disolución 1.8 x 10-2 M Ba(OH)2?
Ba(OH)2 es un base fuerte: 100% disociación.
Inicial 0.018 M 0.0 M 0.0 M
Ba(OH)2 (s) Ba2+ (ac) + 2OH- (ac)
Final 0.0 M 0.018 M 0.036 M
pH = 14.00 – pOH = 14.00 + log(0.036) = 12.56
15.4](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-16-320.jpg)
![Ácidos débiles (HA) y su constante de ionización ácida
HA (ac) + H2O (l) H3O+ (ac) + A- (ac)
HA (ac) H+ (ac) + A- (ac)
[H+][A-]
Ka =
[HA]
Ka es la constante de ionización ácida
ácido débil
Ka
fuerza
15.5](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-17-320.jpg)

![¿Cuál es el pH de una disolución 0.5 M HF (a 250C)?
[H+][F-]
HF (ac) H+ (ac) + F- (ac) Ka = = 7.1 x 10-4
[HF]
HF (ac) H+ (ac) + F- (ac)
Inicial (M) 0.50 0.00 0.00
Cambio (M) -x +x +x
Equilibrio (M) 0.50 - x x x
x2
Ka = = 7.1 x 10-4 Ka << 1 0.50 – x ≈ 0.50
0.50 - x
x2
Ka ≈ = 7.1 x 10-4 x2 = 3.55 x 10-4 x = 0.019 M
0.50
[H+] = [F-] = 0.019 M pH = -log [H+] = 1.72
[HF] = 0.50 – x = 0.48 M
15.5](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-19-320.jpg)

![Cómo resolver los problemas de ionización de ácidos débiles:
1. Identificar las especies principales que pueden afectar el pH.
• En la mayoría de los casos, puede ignorar la autoionización del
agua.
• Ignorar [OH-] porque se determina por [H+].
2. Usar ICE para expresar las concentraciones en equilibrio en términos
de una sola incógnita x.
3. Escríbir Ka en términos de las concentraciones en equilibrio. Resuelva
para x por el método de la aproximación. Si la aproximación no es
válida, resuelva exactamente para x.
4. Calcular las concentraciones de todas las especies y/o pH de la
disolución.
15.5](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-21-320.jpg)

![x2
Ka = = 5.7 x 10-4 x2 + 0.00057x – 6.95 x 10-5 = 0
0.122 - x
-b ± √ b2 – 4ac
ax2 + bx + c =0 x=
2a
x = 0.0081 x = - 0.0081
HA (ac) H+ (ac) + A- (ac)
Inicial(M) 0.122 0.00 0.00
Cambio(M) -x +x +x
Equilibrio(M) 0.122 - x x x
[H+] = x = 0.0081 M pH = -log[H+] = 2.09
15.5](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-23-320.jpg)
![Concentración del
Porcentaje de
ácido
ionización = Concentración el equilibrio
ionizado en inicial del ácido x 100%
Para un ácido monoprótico HA
Porcentaje [H+]
de ionización = x 100% [HA]0 = concentración inicial
[HA]0
Ácido fuerte
% de Ionización
Ácido débil
Concentración inicial del ácido 15.5](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-24-320.jpg)
![Bases débiles y su constante de ionización básica
NH3 (ac) + H2O (l) NH4+ (ac) + OH- (ac)
[NH4+][OH-]
Kb =
[NH3]
Kb es la constante de ionización básica
fuerza
Kb
de base débil
Resuelva los problemas base débil como
ácidos débiles excepto para [OH-] en lugar
de [H+].
15.6](https://image.slidesharecdn.com/diapositivas151-130331155931-phpapp02/85/Acidos-y-bases-25-320.jpg)













