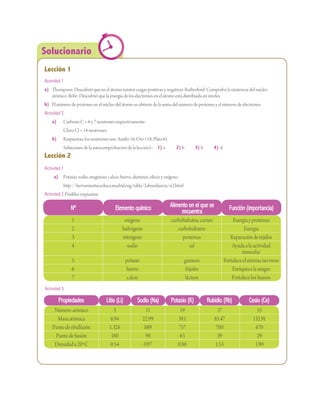
Esta unidad presenta la estructura del átomo, describiendo la evolución de los modelos atómicos desde Dalton hasta el modelo mecánico cuántico actual. Explica que el átomo es la partícula más pequeña de un elemento que conserva sus propiedades, compuesto por un núcleo central con protones y neutrones, y electrones que orbitan en diferentes niveles de energía. También define el número atómico como el número de protones de un átomo, e indica que determina la identidad química de un elemento, y el número másico como la